微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 有两种位于短周期的相邻周期、相邻主族的非金属元素X、Y,已知两元素最高价氧化物的水化物均为强酸。根据下图转化关系(反应条件及部分产物已略去),回答下列问题:
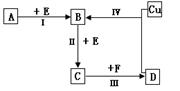
(1)若A、B、C、D均为含X元素的化合物,且A、F的一个分子中都只含有10个电子,则:
①A分子的空间构型为?,F分子的电子式为?。
②反应 I 的化学方程式为?。
③化合物NaX3是合成“达菲”的中间活性物质,也是汽车安全气囊中的主要物质。NaX3受撞击后生成Na3X和另一种气体单质,请写出该反应的化学方程式?。
④ X的氧化物是形成光化学烟雾原因之一,工业上可采用它与其氢化物反应生成无毒害物质而除去,请用方程式表示该反应 ?。
(2)若A、B、C、D均为含Y元素的化合物,其中A由两种元素组成,且A的摩尔质量为120g·mol–1,则:
①将反应IV所得的溶液加热蒸干得到的晶体属于?晶体(填“离子”、“分子”、“原子”)
②反应 I 的化学方程式为?。
③含Y元素的化合物Na2Y和次氯酸钠溶液在强碱性环境中能发生反应,产物无沉淀,请写出该反应的离子反应方程式?。
参考答案:(1)①三角锥形(1分)? H:O:H?② 4NH3 + 5O2 4NO + 6H2O(2分)?③3NaN3 = 4N2↑ + Na3N(2分) ?④6NO2 + 8NH3 = 7N2 + 12H2O或6NO + 4NH3 = 5N2 + 6H2O 或 6NOx + 4xNH3 = (3+2x)N2 + 6xH2O(2分)
4NO + 6H2O(2分)?③3NaN3 = 4N2↑ + Na3N(2分) ?④6NO2 + 8NH3 = 7N2 + 12H2O或6NO + 4NH3 = 5N2 + 6H2O 或 6NOx + 4xNH3 = (3+2x)N2 + 6xH2O(2分)
(2)①离子(1分)?②4FeS2 + 11O2 2Fe2O3 + 8SO2(2分)?③S2– + 4ClO– = SO42– + 4Cl–(2分)
2Fe2O3 + 8SO2(2分)?③S2– + 4ClO– = SO42– + 4Cl–(2分)
本题解析:位于相邻周期、相邻主族、最高价氧化物的水化物均为强酸的两种短周期非金属元素,只能是氮元素和硫元素。
(1)由A的一个分子中都只含有10个电子可知X为是N元素,结合转化关系图可推知A为NH3,B、C、D、E、F分别为NO、NO2、HNO3、O2和H2O。①NH3的空间构型为三角锥形,H2O的电子式为H:O:H。②反应Ⅰ为氨气的催化氧化,生成NO和H2O。③NaX3为NaN3,受撞击后生成Na3N和N2。④氮的氧化物(NO、NO2等)都可以与NH3反应生成无毒害的物质N2和H2O。
(2)Y为硫元素,则B、C、D分别为SO2、SO3和H2SO4,由A+O2→SO2且A的摩尔质量为120g·mol–1可推知A为FeS2(硫铁矿主要成分)。①反应IV为铜与浓硫酸的反应,将溶液蒸干可得到硫酸铜晶体,硫酸铜晶体属于离子晶体。②反应Ⅰ为FeS2与O2反应生成Fe2O3和SO2。③ClO–具有强氧化性,其还原产物为Cl–,因产物无沉淀,所以S2–的氧化产物不是单质硫,只能是SO42–(SO32–还可进一步被氧化),故该反应的离子方程式为:S2– + 4ClO– = SO42– + 4Cl–。
本题难度:一般
2、选择题 下列关于三氧化硫的叙述正确的是()
A.标准状况下三氧化硫是一种无色气体
B.三氧化硫与水反应放出大量的热
C.接触法制硫酸中常用水吸收三氧化硫
D.三氧化硫与氢氧化钠溶液反应生成亚硫酸钠和水
参考答案:B
本题解析:此题主要考查三氧化硫的性质。物理性质:标准状况下为无色固体;化学性质:与水反应放出大量的热,生成硫酸,对应的盐为硫酸盐。
本题难度:简单
3、实验题 (12分)
Ⅰ.(3分)化学反应经常伴随着颜色变化,下列有关反应显示的颜色正确的有
①氢氧化亚铁在空气中最终变为灰绿色;?②淀粉溶液遇碘化钾变为蓝色;
③向硫酸铁溶液中加入KSCN变为红色?④品红溶液通入过量氯气后褪色
⑤无水硫酸铜吸收水蒸气变成浅绿色;?⑥新制氯水久置后变为无色;
Ⅱ.(9分)某化学实验小组同学为了证明、比较SO2和氯水的漂白性,设计了如下图所示的实验装置。

(1) 实验室常选用制CO2的发生装置制SO2;实验室在用MnO2跟浓盐酸反应制备Cl2时,应选用上图A、E两发生装置中??装置(填装置序号)制Cl2。在制Cl2的反应中MnO2表现出的性质是?。
(2) 反应开始后,发现B、D两个试管中的品红溶液都褪去,停止通气后,给B、D两个
试管加热,两个试管中的现象分别为B:?,D:?。
(3) 装置C的作用是?。
(4) 甲乙两同学分别利用下图所示装置探究两种气体按不同比例混合后的漂白性。试分析:
①在气体进入品红溶液之前,先将SO2和Cl2通过盛有浓硫酸装置的目的是:?。

②甲同学在实验过程中发现:通气一段时间后,品红溶液几乎不褪色,其原因是:?,并写出其相应的离子方程式:?。
③乙同学在实验过程中发现:通气一段时间后,品红溶液颜色随时间推移变得越来越浅,其原因是:?。
参考答案:

本题解析:略
本题难度:一般
4、选择题 BaCl2有剧毒,致死量为0.8g,万一不慎误服,应大量吞服鸡蛋清来解毒,并加服一定量药剂,此药剂的主要成分是(?)
A.AgNO3
B.Na2SO4
C.Na2CO3
D.MgCl2
参考答案:B
本题解析:BaCl2能引起体内蛋白质的性质改变,引起中毒,可设法使其形成BaSO4沉淀来大大降低毒性。Na2CO3与BaCl2反应生成的BaCO3溶于酸,只有选Na2SO4较妥当。
本题难度:简单
5、选择题 将SO2通入BaCl?2溶液至饱和,未见有沉淀,继续通入另一种气体X仍无沉淀,则X可能是:
A.CO2
B.NH3
C.NO2
D.H2S
参考答案:A
本题解析:A、SO2与CO2都不与BaCl2反应,并且所对应的酸都比盐酸弱,通入SO2与CO2都不会生成沉淀,故A选;B、Cl2具有氧化性,在溶液中将SO2氧化为SO42-离子,生成沉淀BaSO4,故B不选;C、通入NH3溶液呈碱性,溶液中生成大量的SO32-离子,生成沉淀BaSO3,故C不选;D、NO2与水反应生成具有氧化性的硝酸,在溶液中将SO2氧化为SO42-离子,生成沉淀BaSO4,故D不选;
本题难度:一般