微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列过程中,属于放热反应的有(?)
①石油液化气燃烧?②碳酸钙分解?③硝酸铵溶于水?④铁与氧气反应
A.①③
B.①④
C.②③
D.②④
参考答案:B
本题解析:考查常见的放热反应和吸热反应。一般金属和水或酸反应,酸碱中和反应,一切燃烧,大多数化合反应和置换反应,缓慢氧化反应如生锈等是放热反应。大多数分解反应,铵盐和碱反应,碳、氢气或CO作还原剂的反应等是吸热反应。所以答案选B。
本题难度:简单
2、实验题 (9分)用右图所示装置进行中和热测定实验,请回答下列问题:
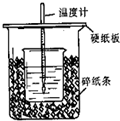
(1)大小烧杯之间填满碎泡沫塑料的作用是 ,从实验装置上看,图中缺少的一种玻璃仪器是 。
(2)使用补全仪器后的装置进行实验,取50m L 0.25mol/L H2SO4溶液与50mL0.55 mol/L NaOH溶液在小烧杯中进行中和反应,三次实验温度平均升高3.4℃。已知中和后生成的溶液的 比热容为4.18J/(g·℃),溶液的密度均为1g/cm3。通过计算可得中和热△H= ,
H2SO4与NaOH反应的热化学方程式为 。
(3)实验中若用60mL0.25mol·L-1H2SO4溶液跟50mL0.55mol·L-1NaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等”.“不相等”),所求中和热 (填“相等”.“不相等”),若用50mL0.50mol·L-1醋酸代替H2SO4溶液进行上述实验,测得反应前后温度的变化值会 (填“偏大”、“偏小”、“不受影响”)。
参考答案:(1) 保温、隔热、减少实验过程中的热量损失(1分); 环形玻璃搅拌棒(1分)
(2) -56.8kJ?mol-1 (2分) , H2SO4(aq)+2NaOH(aq)= Na2SO4(aq)+2H2O(l);ΔH=-113.6kJ?mol-1 (2分)
(3) 不相等 (1分) , 相等 (1分) , 偏小 (1分)
本题解析:(1)中和热测定实验成败的关键是保温工作,大小烧杯之间填满碎泡沫塑料的作用是:保温、隔热、减少实验过程中的热量散失,根据量热计的构造可知该装置的缺少仪器是环形玻璃搅拌器;
(2)Q= 3.4°C×4.18J/(g?℃)×100g=1421.2J=1.42KJ,
△H = ;热化学方程式为:
;热化学方程式为:
H2SO4(aq)+2NaOH(aq)= Na2SO4(aq)+2H2O(l);ΔH=-113.6kJ?mol-1
(3)反应放出的热量和所用酸以及碱的量的多少有关,并若用60mL0.25mol?L-1H2SO4溶液跟50mL0.55mol?L-1NaOH溶液进行反应,与上述实验相比,生成水的量增多,所放出的热量偏高,但是中和热的均是强酸和强碱反应生成1mol水时放出的热,中和热相等;又醋酸是弱酸,电离过程吸热,所以用50mL0.50mol?L-1醋酸代替H2SO4溶液进行上述实验,测得反应前后温度的变化值会减小。
考点:中和热的测定。
点评:本题考查学生有关中和热的测定知识,可以根据所学知识进行回答,难度不大。
本题难度:困难
3、选择题 下列反应中符合图示能量变化的是
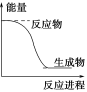
A.碳与二氧化碳化合成为一氧化碳
B.HCl分解为H2和Cl2
C.Na与H2O反应
D.Ba(OH)2·8H2O和NH4Cl晶体混合反应