| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学必备知识点《原电池原理》高频试题预测(2017年最新版)(四)
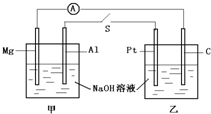 参考答案:关闭开关S甲装置形成原电池反应,铝做负极失电子发生氧化反应,镁做正极,电极上得到电子发生还原反应,乙池为电解池,Pt做电解池阴极,C做电解池的阳极; 本题解析: 本题难度:简单 4、填空题 (3分)用导线将锌片、铜片连接后浸入稀硫酸溶液中,构成了原电池,此电池的负极是 ,正极的电极反应式是 。 参考答案:略 本题解析:略 本题难度:一般 5、填空题 (10分)某兴趣小组的同学用下图所示装置研究有关电化学的问题(甲、乙、丙三池中的溶质足量),当闭合该装置的电键K时,观察到电流表的指针发生了偏转。 |
参考答案:(1)原电池(1分) CH3OH+8OH--6e-===CO32-+6H2O(2分)(2)阴极(1分) 2CuSO4+2H2O===2H2SO4+2Cu+O2↑(2分)(3)224mL(2分)(4)A(2分)
本题解析:(1)从图可以看出甲是一个甲醇燃料电池,燃料电池是原电池,在燃料电池中燃料反应的一极是负极,氧气反应的一极是正极,所以A是负极、B是正极,由于电解质溶液是KOH溶液,所以甲醇反应生成的CO2不能以气体的形式释放出去,而是与OH-反应生成CO32-,则A电极反应方程式为:2CH3OH+16OH--12e-="==2" CO32-+12H2O。(2)甲是原电池,那么乙和丙都是池为电解池,丙中F接原电池的负极,作阴极,丙池中就是用惰性材料电解CuSO4溶液,电池的总反应为:2CuSO4+2H2O===2H2SO4+2Cu+O2↑。(3)乙池中C接电源的正极,作为阳极,Ag是活性材料,所以是Ag放电,电极反应为:Ag- e-=Ag+,C极质量减轻4.32g,则反应的Ag的物质的量为:4.32g÷108g/mol=0.04mol,根据反应知道反应0.04molAg时转移的电子为0.04mol,再根据B电极反应式为:O2+4e-+ 2H2O=4OH-,转移0.04mol电子时反应的O2的物质的量为0.01mol,O2体积为0.01 mol×22.4L/mol=0.224L=224mL。(4)电解时乙池中C的电极反应为:Ag- e-=Ag+,D的电极反应为Cu2++2e-=Cu,可以看出溶液中多了Ag+,少了Cu2+,要恢复反应前的浓度可以加入Cu,将其中的Ag+置换出来即可,选A。
考点:原电池和电解池的判断、原电池和电解池的工作原理、电极反应的书写、电子转移的计算等。
本题难度:困难
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点大全《原电池原理.. | |