微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (10分)(1)实验室里常用浓盐酸与二氧化锰反应来制取少量的氯气,反应的化学方程式为:MnO2+4HCl(浓)  MnCl2+Cl2↑+2H2O,取一定量的浓盐酸使其与二氧化锰发生反应,产生的氯气在标准状况下的体积为22.4 L。
MnCl2+Cl2↑+2H2O,取一定量的浓盐酸使其与二氧化锰发生反应,产生的氯气在标准状况下的体积为22.4 L。
请回答下列问题:
①写出该反应的离子反应方程式_________________________,②反应中被氧化的HCl的物质的量为 ________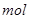 。③实验室备用的浓盐酸质量分数为36.5%,密度为1.19 g·cm-3,为使用方便,请计算出该浓盐酸的物质的量浓度_________
。③实验室备用的浓盐酸质量分数为36.5%,密度为1.19 g·cm-3,为使用方便,请计算出该浓盐酸的物质的量浓度_________ 。
。
(2)把一小块镁铝合金溶于100mL盐酸中,然后向其中滴入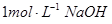 溶液,生成沉淀的质量和加入NaOH溶液的体积如下图所示。
溶液,生成沉淀的质量和加入NaOH溶液的体积如下图所示。

①合金中镁的质量 g。
②盐酸的物质的量浓度  。
。
参考答案:①MnO2+2Cl-+4H+===Mn2++Cl2↑+2H2O
②2 mol③11.9 mol·L-1 (2) 0.12 0.5
本题解析:本题涉及Cl2的实验室制法,难度不大。结合图像的计算也属基础题型,关键结合题给信息,分析图中的数据再根据方程式计算可得。10mLNaOH用于中和盐酸,40mLNaOH用于沉淀Mg2+ 、Al3+;Cl-转化为NaCl,由Na+可确定Cl-的量,即HCl的物质的量,为0.05mol;可求得盐酸的浓度为0.5mol/L;结合图像B C发生反应Al(OH)3+OH-=AlO2-+2H2O,计算消耗NaOH的物质的量为0.01mol,可知用于沉淀Al3+的OH-为0.03mol,则其余用于沉淀Mg2+,由反应Mg2++2OH-=Mg(OH)2↓可求得Mg2+的物质的量为0.005mol,从而金属Mg的质量为0.12g。
C发生反应Al(OH)3+OH-=AlO2-+2H2O,计算消耗NaOH的物质的量为0.01mol,可知用于沉淀Al3+的OH-为0.03mol,则其余用于沉淀Mg2+,由反应Mg2++2OH-=Mg(OH)2↓可求得Mg2+的物质的量为0.005mol,从而金属Mg的质量为0.12g。
考点:化学计算。
本题难度:一般
2、选择题 阿伏加德罗常数约为6.02×1023mol-1,下列叙述中错误的是
①12.4g?白磷晶体中含有的P-P键数是0.6×6.02×1023
②含0.2mol?H2SO4的浓硫酸与足量铜反应,生成SO2的分子数为0.1×6.02×1023
③7.8g?Na2S和Na2O2的混合物中含有的阴离子数大于0.1×6.02×1023
④2mol?SO2和1mol?O2在V2O5存在的条件下于密闭容器中加热反应后,容器内物质分子数等于2×6.02×1023
⑤2.9g?2CaSO4?H2O含有的结晶水分子数为0.02×6.02×1023
A.①②③④⑤
B.①③④⑤、
C.②③④⑤
D.③④⑤
参考答案:C
本题解析:略
本题难度:一般
3、选择题 用NA表示阿伏加德罗常数的值,下列说法正确的是
A.1mol Na2O2固体中含离子总数为4 NA
B.标准状况下,2.24L氨气所含共价键数为0.3 NA
C.5.6g铁和足量Cl2充分反应,转移的电子数为0.2NA
D.标准状况下,22.4 L CCl4含有的分子总数为NA
参考答案:B
本题解析:过氧化钠中阴阳离子的个数之比是1:2,所以1mol Na2O2固体中含离子总数为3NA,A不正确;标准状况下,2.24L氨气的物质的量是0.1mol,所含共价键数为0.3 NA,B正确;铁在和氯气的反应中失去3个电子,所以5.6g铁和足量Cl2充分反应,转移的电子数为0.3NA,C不正确;标准状况下,四氯化碳不是气态,不能适用于气体摩尔体积,D不正确,答案选B。
点评:阿伏加德罗常数是历年高考的“热点”问题,这是由于它既考查了学生对物质的量、粒子数、质量、体积等与阿伏加德罗常数关系的理解,又可以涵盖多角度的化学知识内容。要准确解答好这类题目,一是要掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系;二是要准确弄清分子、原子、原子核内质子中子及核外电子的构成关系。
本题难度:一般
4、计算题 (6分)标准状况下,CO2和CO的混合气体7.2g,体积为4.48L,则此混合气体中CO2和CO的物质的量各是多少?
参考答案:0.1mol? 0.1mol
本题解析:略
本题难度:一般
5、选择题 阿伏加德罗常数约为6.02×1023mol-1,下列叙述正确的是
A.5.6g铁粉与硝酸反应失去的电子数一定为0.3 ×6.02×1023
B.2.24 L CO2中含有的原子数为0.3×6.02×1023
C.200 mL 5 mol·L-1 Na2CO3溶液中,含6.02×1023个CO32—
D.4.5gSiO2晶体中含有的硅氧键数目为0.3×6.02×1023
参考答案:D
本题解析:略
本题难度:简单