微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 实验室用98%的浓硫酸(密度为1.84g/mL)配制0.5mo1/L硫酸溶液500mL,不需要使用的仪器是( )
A.500?mL容量瓶
B.25?mL量筒
C.烧杯
D.天平
参考答案:D
本题解析:
本题难度:简单
2、填空题 取出的10mL溶液中,AlO2-的物质的量浓度为 ;
参考答案:55.0.5mol/L
本题解析:根据AlO2- + 4H+=Al3++2H2O
1 4
X 0.02 解得X=0.005mol,则AlO2-的物质的量浓度为0.005/0.01=0.5mol/L.
考点:考查
本题难度:简单
3、计算题 19.2g Cu与过量的50 mL 18 mol·L-1浓硫酸加热完全反应后,
反应方程式如下: Cu + 2H2SO4(浓)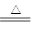 CuSO4?+ SO2↑+ 2H2O 。
CuSO4?+ SO2↑+ 2H2O 。
(1)得到SO2气体的体积(标准状况下)是?L;
(2)若反应后溶液中加入水至溶液的体积为500mL,取出50mL,那么50mL溶液中CuSO4?的物质的量浓度为?mol·L-1;
(3)往反应后溶液中加入足量的BaCl2,可以生成硫酸钡沉淀为?g。
参考答案:(1)6. 72?(2) 0.6 ?(3) 139.8
本题解析:19.2gCu为0.3mol,与足量浓硫酸生成0.3molSO2;同时生成0.3molCuSO4,将溶液稀释至500mL,物质的量浓度为0.6mol/L;反应后溶液中SO42-物质的量为(0.05×18-0.3)mol=0.6mol,向反应后的溶液中加入足量氯化钡溶液生成硫酸钡0.6mol。
点评:本题(3)应用元素守恒的思想。反应前硫总物质的量为0.9mol,生成SO2中S为0.3mol,所以残留溶液中SO42-为0.6mol。
本题难度:一般
4、选择题 设NA为阿伏加德罗常数的值。下列说法正确的是?(? )
A.常温常压下,16 g由O2和O3组成的混合气体所含电子数为8NA
B.实验室分别用KClO3和H2O2制取3.2g O2时,转移的的电子数均为0.4NA
C.25℃时,1 L pH=1的稀硫酸中约含2NA个H+
D.标准状况下,22.4 L SO3所含分子数为NA
参考答案:A
本题解析:略
本题难度:简单
5、计算题 某化合物的化学式可表示为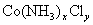 (x、y为正整数)。为了确定x和y的值,取两份质量均为0.2140g的该化合物进行如下两个实验。将一份试样溶于水,在硝酸存在的条件下用
(x、y为正整数)。为了确定x和y的值,取两份质量均为0.2140g的该化合物进行如下两个实验。将一份试样溶于水,在硝酸存在的条件下用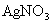 溶液滴定(生成
溶液滴定(生成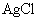 沉淀),共消耗24.0mL 0.100mol/L的
沉淀),共消耗24.0mL 0.100mol/L的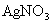 溶液。在另一份试样中加入过量
溶液。在另一份试样中加入过量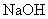 溶液并加热,用足量盐酸吸收逸出的
溶液并加热,用足量盐酸吸收逸出的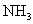 。吸收
。吸收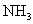 共消耗24.0mL 0.200mol/L
共消耗24.0mL 0.200mol/L 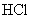 溶液。试通过计算确定该化合物的化学式。(本题可能用到的相对原子质量:H为1.00、N为14.0、Cl为35.5、Co为58.9)
溶液。试通过计算确定该化合物的化学式。(本题可能用到的相对原子质量:H为1.00、N为14.0、Cl为35.5、Co为58.9)
参考答案:解答:n表示物质的量,m表示质量
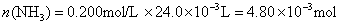
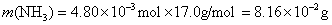
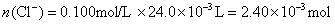




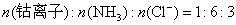
该化合物的化学式为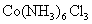 。
。
启示:同一习题,提倡一题多解,培养发散思维能力。如本题亦可有如下解法:
解法1:设0.2140g化合物的物质的量为n,根据关系式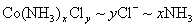 ,得方程:
,得方程:
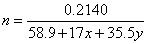 ①
①
 ②
②
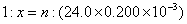 ③
③
联立①②③,解之得: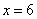 ,
,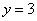 。
。
该化合物的化学式为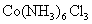 。
。
解法2:n表示物质的量,
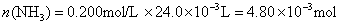
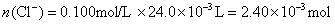
根据题意列方程组:
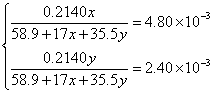 ?解方程组得:
?解方程组得: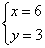
该化合物的化学式为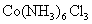 。
。
解法3:n表示物质的量。
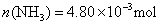
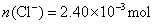
 ?即:
?即:
该化合物化学式可写成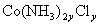 ,由题意得:
,由题意得:
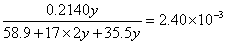 ?解之得:
?解之得: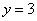
该化合物的化学式为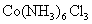 。
。
解法4:设0.2140g化合物的物质的量为c。

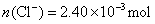
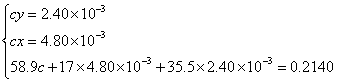
解联立方程得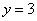 ,
,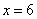 ,所以,其化学式为
,所以,其化学式为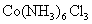 。
。

联立①、②解得: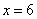 ,
,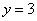 ,故化学式为
,故化学式为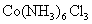 。
。
本题解析:此题有多种解法,训练学生的发散思维。
从消耗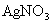 的物质的量可得化合物中
的物质的量可得化合物中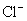 的物质的量;由吸收
的物质的量;由吸收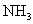 所消耗
所消耗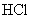 的物质的量可得
的物质的量可得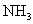 的物质的量,由试样质量减去
的物质的量,由试样质量减去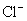 和
和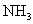 的质量可得钴离子的质量,除以钴的相对原子质量即得钴离子的物质的量。以钴离子的物质的量为1,即可确定x和y。
的质量可得钴离子的质量,除以钴的相对原子质量即得钴离子的物质的量。以钴离子的物质的量为1,即可确定x和y。
本题难度:简单