微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 实验室用98%的浓硫酸(密度为1.84g/mL)配制0.5mo1/L硫酸溶液500mL,不需要使用的仪器是( )
A.500?mL容量瓶
B.25?mL量筒
C.烧杯
D.天平
2、填空题 取出的10mL溶液中,AlO2-的物质的量浓度为 ;
3、计算题 19.2g Cu与过量的50 mL 18 mol·L-1浓硫酸加热完全反应后,
反应方程式如下: Cu + 2H2SO4(浓)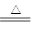 CuSO4?+ SO2↑+ 2H2O 。
CuSO4?+ SO2↑+ 2H2O 。
(1)得到SO2气体的体积(标准状况下)是?L;
(2)若反应后溶液中加入水至溶液的体积为500mL,取出50mL,那么50mL溶液中CuSO4?的物质的量浓度为?mol·L-1;
(3)往反应后溶液中加入足量的BaCl2,可以生成硫酸钡沉淀为?g。
4、选择题 设NA为阿伏加德罗常数的值。下列说法正确的是?(? )
A.常温常压下,16 g由O2和O3组成的混合气体所含电子数为8NA
B.实验室分别用KClO3和H2O2制取3.2g O2时,转移的的电子数均为0.4NA
C.25℃时,1 L pH=1的稀硫酸中约含2NA个H+
D.标准状况下,22.4 L SO3所含分子数为NA
5、计算题 某化合物的化学式可表示为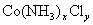 (x、y为正整数)。为了确定x和y的值,取两份质量均为0.2140g的该化合物进行如下两个实验。将一份试样溶于水,在硝酸存在的条件下用
(x、y为正整数)。为了确定x和y的值,取两份质量均为0.2140g的该化合物进行如下两个实验。将一份试样溶于水,在硝酸存在的条件下用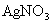 溶液滴定(生成
溶液滴定(生成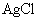 沉淀),共消耗24.0mL 0.100mol/L的
沉淀),共消耗24.0mL 0.100mol/L的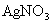 溶液。在另一份试样中加入过量
溶液。在另一份试样中加入过量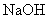 溶液并加热,用足量盐酸吸收逸出的
溶液并加热,用足量盐酸吸收逸出的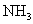 。吸收
。吸收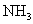 共消耗24.0mL 0.200mol/L
共消耗24.0mL 0.200mol/L 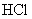 溶液。试通过计算确定该化合物的化学式。(本题可能用到的相对原子质量:H为1.00、N为14.0、Cl为35.5、Co为58.9)
溶液。试通过计算确定该化合物的化学式。(本题可能用到的相对原子质量:H为1.00、N为14.0、Cl为35.5、Co为58.9)