微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 A、B、C、D是四种短周期元素,它们的原子序数依次增大,其中A、C及B、D分别是同一主族元素,B、D两元素的原子核中质子数之和是A、C两元素原子核中质子数之和的两倍,又知四种元素的单质中有两种气体、两种固体。
(1) A??;D?(填元素名称)
(2)写出C、D两元素形成的常见化合物的电子式?;写出由A、B两元素形成的18电子微粒中所含化学键类型?。
(3)用A元素的单质与B元素的单质可以制成电池,电池中装有KOH浓溶液,用多孔的金属惰性电极浸入KOH溶液,两极均有特制的防止气体透过的隔膜。在一极通人A的单质,另一极通人B的单质,写出该电池发生的电极反应式:
通入A单质的一极:?;
通入B单质的一极:?。?
(4)由A、B、C 三元素构成的化合物X,常在试验制备过程中起尾气吸收作用。请写出化合物X吸收NO2 时所发生反应的离子方程式:??。
参考答案:(1) 氢?;硫(各1分)?
(2)??;(2分);极性共价键、非极性共价键(各一分,只答共价键得一分)
(3)2H2 -4e- + 4OH- = 4H2O? O2 +4e- + 2H2O =4OH-(各2分)
(4)2NO2 +2OH- = NO3- +NO2- + H2O(2分)
本题解析:根据元素的结构及有关性质可知,A,B,C,D分别是H、O、Na、S。(1)名称分别是氢、氧、钠、硫。(2))写出C、D两元素形成的常见化合物是硫化钠,其电子式要体现出阴阳离子形式;钠和S都是活泼的金属和非金属,形成的化学键是离子键,电子式为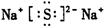 。A、B两元素形成的18电子微粒是过氧化氢,其中所含化学键类型极性共价键、非极性共价键。符合条件的两种物质分别是硫酸氢钠和亚硫酸氢钠,方程式为HSO3-+H+=SO2↑+H2O。(3)原电池中负极失去电子,发生氧化反应。正极得到电子,发生还原反应,所以氢气在负极通入,氧气在正极通入。又因为溶液显碱性,所以电极反应式为负极:
。A、B两元素形成的18电子微粒是过氧化氢,其中所含化学键类型极性共价键、非极性共价键。符合条件的两种物质分别是硫酸氢钠和亚硫酸氢钠,方程式为HSO3-+H+=SO2↑+H2O。(3)原电池中负极失去电子,发生氧化反应。正极得到电子,发生还原反应,所以氢气在负极通入,氧气在正极通入。又因为溶液显碱性,所以电极反应式为负极: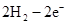

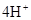 ,正极:
,正极: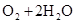
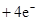

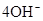 。(4)由A、B、C 三元素构成的化合物X是氢氧化钠,离子方程式为:2NO2 +2OH- = NO3- +NO2- + H2O。
。(4)由A、B、C 三元素构成的化合物X是氢氧化钠,离子方程式为:2NO2 +2OH- = NO3- +NO2- + H2O。
本题难度:一般
2、选择题 下列说法不正确的是
A.化学反应的实质是旧键的断裂,新键的形成
B.石墨转化为金刚石的反应是吸热反应,说明金刚石比石墨稳定
C.原电池反应的实质是自发进行的氧化还原反应
D.元素周期律的实质是元素原子核外电子排布呈周期性变化
参考答案:B
本题解析:石墨转化为金刚石的反应是吸热反应,这说明石墨的总能量低于金刚石的总能量,所以石墨比金刚石稳定,选项B不正确,其余选项都是正确的,答案选B。
点评:该题是基础性知识的考查,考查的知识点比较分散,但都很基础。有利于巩固学生的基础知识,提高学生灵活运用基础知识解决实际问题的能力,也有利于调动学生的学习兴趣,激发学生的求知欲。
本题难度:一般
3、选择题 下列各离子化合物中,阳离子与阴离子的半径之比最小的是( ? )
A.KCl
B.NaBr
C.LiI
D.KF
参考答案:C
本题解析:四选项中阳离子半径最小的为:Li+,阴离子半径中最大的为:I—;故C项符合题意
本题难度:简单
4、填空题 A、B、C、D、E为五种原子序数依次增大的短周期主族元素。已知B的最外层电子数
与核外电子总数之比为3∶4;D的最外层电子数与次外层电子数之比为3∶4;E-、C+、A+的半径逐渐减小;常温下化合物AE为气体。
请回答下列问题:
(1)D、E的最高价氧化物对应水化物酸性较强的是________(写化学式)。
(2)用惰性电极电解化合物CE的饱和溶液,当电路中有0.2 mol电子通过时两极产生的气体在标准状况下的体积共________L。
(3)A与B、A与D均可形成18电子分子,这两种分子在水溶液中反应有黄色沉淀生成,写出该反应的化学方程式:________。
(4)化合物乙、丙均为由上述五种元素中的任意三种元素组成的强电解质,且两种物质水溶液的酸碱性相同,组成元素的原子数目之比为1∶1∶1,乙溶液中水的电离程度比纯水的小。则化合物乙中的化学键类型为________;若丙为常见家用消毒剂的主要成分,则丙的化学式是________。
(5)均由A、B、C、D四种元素组成的两种盐发生反应的离子方程式是________;其中一种是强酸对应的酸式盐,写出向Ba(OH)2溶液中逐滴加入该盐溶液至中性发生反应的离子方程式:________。
参考答案:(1)HClO4
(2)4.48
(3)H2O2+H2S=S↓+2H2O
(4)离子键、(极性)共价键 NaClO
(5)HSO3-+H+=H2O+SO2↑ Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O
本题解析:短周期元素的内层电子数可能是2或10,设B的最外层电子数为x,则x∶(2+x)=3∶4,x=6,或x∶(10+x)=3∶4,x=30,不存在,因此元素B为O;次外层电子数可能是2或8,D的次外层电子数只能为8,最外层电子数为6,因此元素D为S;相应的元素E只能是Cl,由于AE常温下为气体,A显+1价,因此元素A为H,根据C+,且原子序数介于8和16之间,得出元素C为Na。
(1)D、E的最高价氧化物对应的水化物分别是H2SO4、HClO4,由于Cl的非金属性较强,所以HClO4的酸性强于H2SO4的。(2)电解氯化钠溶液时,阳、阴两极,分别发生反应2Cl--2e-=Cl2↑、2H++2e-=H2↑,共得到0.2 mol气体,在标准状况下的体积为4.48 L。(3)A与B、A与D形成的18电子的分子分别是H2O2、H2S,两者发生氧化还原反应得到单质S。(4)乙和丙都是强电解质,可能是钠的化合物,乙抑制水的电离,可能是碱或酸,因此乙是氢氧化钠,丙是常见家用消毒剂的主要成分,应为次氯酸钠。(5)由A、B、C、D四种元素组成的两种盐可能是硫酸氢钠和亚硫酸氢钠,两者能发生反应。
本题难度:一般
5、选择题 A、B、C、D四种元素,已知A元素是地壳中含量最多的元素;B元素为金属元素,它的原子核外K、L层上电子数之和等于M、N层电子数之和;C元素是第3周期第一电离能最小的元素;D元素在第3周期中第一电离能最大。下列有关叙述错误的是
A.四种元素A、B、C、D分别为O、Ca、Na、Ar
B.元素A、B、C两两组成的化合物可为CaO、CaO2、Na2O、Na2O2等
C.元素A、C简单离子的半径大小关系为A<C
D.元素B、C电负性大小关系为B>C
参考答案:C
本题解析:
答案:C
A元素是地壳中含量最多的元素,A为O;B元素为金属元素,它的原子核外K、L层上电子数之和等于M、N层电子数之和,B为Ca;C元素是第3周期第一电离能最小的元素,C为Na;D元素在第3周期中第一电离能最大,?D为Ar。
A、正确;B、正确,能形成金属的氧化物和过氧化物;C、不正确,半径O2― >Na+?;D、正确。
本题难度:一般