微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 医疗上使用放射性核素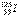 治疗肿瘤,该核素原子核内的中子数与电子数之差是
治疗肿瘤,该核素原子核内的中子数与电子数之差是
A.19
B.53
C.72
D.125
参考答案:A
本题解析:略
本题难度:简单
2、填空题 (15分)已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数依次增加。相关信息如下表所示,根据推断回答下列问题:(答题时A、B、C、D、E用所对应的元素符号表示)
A
| A的最高价氧化物对应的水化物化学式为H2AO3
|
B
| B元素的第一电离能比同周期相邻两个元素都大
|
C
| C原子在同周期原子中半径最大(稀有气体除外),其单质焰色为黄色
|
D
| Z的基态原子最外层电子排布式为3s23p2
|
E
| E与C位于不同周期,E原子核外最外层电子数与C相同,其余各层电子均充满
|
(1)C在周期表中位于第 周期第 族,E基态原子核外电子排布式是
(2)A、B、D三种元素电负性由大到小排列顺序为 ,其中A的最高价氯化物构成晶体的微粒间作用力为
(3)A和B的最简单氢化物中较稳定的是 (填化学式)。B的最简单氢化物和E的黑色氧化物固体在加热时可反应,写出其反应方程式
(4)E的单质和过氧化氢在稀硫酸中可反应,有人将这个反应设计成原电池,请写出正极反应方程式
(5)煤燃烧产生的烟气中有B的氧化物,会引起严重的环境问题,因此,常用AH4催化还原以消除污染,已知:?
① AH4(g)+2 BO2(g)= B2(g)+AO2(g)+2H2O (g)? △H1=-867kJ/mol
② 2BO2(g) ?B2O4(g)? △H2=-56.9 kJ/mol
写出AH4和B2O4反应的热化学方程式
参考答案:(1)三ⅠA,[Ar]3d104s1;(2)N>C>Si,分子间作用力(范德华力);
(3)NH3? 2NH3+3CuO 3Cu+N2+3H2O;(4)H2O2+2e-+2H+=2H2O;
3Cu+N2+3H2O;(4)H2O2+2e-+2H+=2H2O;
(5)CH4(g)+N2O4(g)=N2(g)+CO2(g)+2H2O(g)?△H=-810.1KJ/mol
本题解析:根据题意可得:A是C;B是N;C是Na;D是Si;E是Cu。(1)Na在周期表中位于第三周期第ⅠA族;29号元素Cu基态原子核外电子排布式是1s22s22p63s23p63d104s1或[Ar]3d104s1;(2)C、N、Si三种元素的非金属性N>C>Si,元素的非金属性越强,元素的电负性就越大。因此元素的电负性由大到小排列顺序为N>C>Si。其中C元素的最高价氯化物CCl4构成晶体的分子晶体,分子间的作用力是分子间作用力也叫范德华力。(3)元素的非金属性越强,其氢化物的稳定性就越强,元素的非金属性N>C。所以CH4和NH3中较稳定的是NH3。根据电子守恒及质量守恒定律可得NH3和CuO固体在加热时反应的方程式是2NH3+3CuO 3Cu+N2+3H2O。(4)Cu单质和过氧化氢在稀硫酸中可反应,可将这个反应设计成原电池,正极反应方程式H2O2+2e-+2H+=2H2O;负极的电极反应式为Cu-2e-=Cu2+。(5) ①-②整理可得:CH4(g)+N2O4(g)=N2(g)+CO2(g)+2H2O(g)?△H=-810.1KJ/mol。
3Cu+N2+3H2O。(4)Cu单质和过氧化氢在稀硫酸中可反应,可将这个反应设计成原电池,正极反应方程式H2O2+2e-+2H+=2H2O;负极的电极反应式为Cu-2e-=Cu2+。(5) ①-②整理可得:CH4(g)+N2O4(g)=N2(g)+CO2(g)+2H2O(g)?△H=-810.1KJ/mol。
本题难度:一般
3、选择题 Q、W、X、Y、Z都是短周期元素。X、Y、Q在周期表中的位置关系如图。W、Z的最外层电子数相同,Z的核电荷数是W的2倍。则下列说法不正确的是
?
A.非金属性:W > Z
B.原子半径:X >Y > Z
C.最高价氧化物对应水化物的碱性:X > Y
D.氢化物稳定性:Q > W
参考答案:D
本题解析:根据核外电子排布原理,设W、Z的电子数分别为2+x、2+8+x,则(2+x)×2=2+8+x,解得:x=6,说明W、Z分别是氧、硫,同主族元素的非金属性随核电荷数增大而减弱,则氧的非金属性比硫强,故A正确;读图可知元素在周期表中的位置,则X、Y、Q分别是钠、铝、碳,同周期主族元素的原子半径随核电荷数增大而减小,则原子半径:Na>Al>S,故B正确;同周期主族元素的金属性随核电荷数增大而减弱,则钠的金属性比铝强,由于金属性越强,最高价氧化物对应水化物的碱性越强,则碱性:NaOH>Al(OH)3,故C正确;同周期主族元素的非金属性随核电荷数增大而增强,则碳的非金属性比氧弱,由于非金属性越强,气态氢化物越稳定,则稳定性:CH4<H2O,故D错误。
本题难度:简单
4、选择题 有A、B、C、D四种同周期元素,元素E与 C不同周期。A、B的最高价氧化物的水化物呈碱性,且B比A的碱性强,C、D的最高价氧化物的水化物是酸,且C比D的酸性强, E是这五种元素中原子半径最大的,则它们的原子序数由小到大的顺序是
A.E、C、D、B、A?B.B、A、D、C、E
C.E、B、A、D、C? D.A、B、C、D、E
参考答案:B
本题解析:同周期自左向右,原子半径逐渐减小,金属性逐渐减弱,非金属性逐渐增强。最高价氧化物的水化物的酸性逐渐增强,碱性逐渐减弱。根据A、B的最高价氧化物的水化物呈碱性,且B比A的碱性强可知,B的原子序数小于A的。C、D的最高价氧化物的水化物是酸,且C比D的酸性强,则C的原子序数大于D,且二者的原子序数均大于AB的。E是这五种元素中原子半径最大的,且元素E与 C不同周期,所以E的原子序数是最大的,答案选B。
点评:该题是中等难度的试题,试题基础性强,侧重对学生灵活运用基础知识解决实际问题的能力的培养。该题的关键是熟练掌握元素周期表的结构和元素周期律,然后灵活运用即可。
本题难度:一般
5、选择题 下列说法正确的是? ?(?)
?(?)
A.原子半径:Cl>S>P
B.还原性:Na>Mg>Al
C.稳定性:HF>HCl>HBr
D.酸性:HClO4>H2SO4>H3PO4
参考答案:BCD
本题解析:略
本题难度:简单