微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 锌钡白是BaSO4和ZnS的混合物,ZnS难溶于水。某化工厂用重晶石为原料制备锌钡白,生产过程中会产生大量废气(主要成分为CO2、CO及少量SO2和硫蒸气等),为防止污染空气并提高原料利用率,生产中采用下述工艺流程
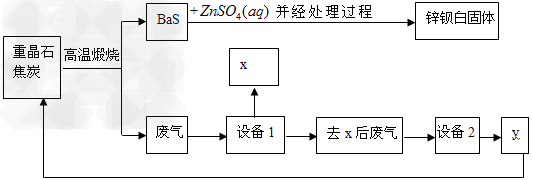
请根据上述流程回答下列问题:
(1)重晶石的化学式为_____,锌钡白可用于调制_____色和浅色油漆。
(2)处理过程的步骤为:①__________;②洗涤;③__________。
(3)设备1是冷却分离塔,若设备1前面的导气管过长、过窄,可能使导气管堵塞,其原因是____________________。
(4)检验锌钡白中含有S2-的方法是__________。
(5)设备2中所用的洗涤剂是NaOH溶液,则y的化学式为__________。写出设备2中发生反应的离子方程式:_______________、_______________。
(6)可用_____法分离设备2溶液中的钠盐,进行分离前,需要查得的是__________。
(7)制备过程中得到的硫磺,除了可用来制硫酸外,其它的用途为__________(至少写一种)。
参考答案:(1)BaSO4;白
(2)①过滤;? ③干燥
(3)硫蒸气冷却变成了固体
(4)取样品加入盐酸,若产生的气体能使湿的醋酸铅试纸变黑,说明有硫离子
(5)CO;SO2+2OH-→SO32-+H2O;CO2+2OH-→CO32-+H2O
(6)结晶;各物质的溶解度随温度的变化情况
(7)橡胶、火药、农药、治皮肤病等
本题解析:
本题难度:一般
2、填空题 【三选一—选修化学与技术】
晶体硅可用作制芯片和太阳能电池等。下列流程图是工业上制取纯硅的一种方法。

请回答下列问题(各元素用相应的元素符号表示)。
(1)在上述生产过程中,属于置换反应的有__(填反应的代号“I~Ⅳ”)。
(2)A、B、C三种气体在上述生产过程中可循环利用的是___;在“节能减排”中作为减排目标的一种气体是___。
(3)化合物甲的用途很广,有些已应用于高、精、尖科技领域。通常可作建筑工业和造纸工业上的黏合剂。将石英砂和纯碱按一定比例混合加热至1373~1 623 K反应生成化合物甲,其化学方程式为___。
(4)利用反应Ⅲ能制得纯硅的原因是___。
(5)已知反应Ⅳ中产物的总能量比反应物的总能量低,则在密闭容器内反应Ⅳ达到平衡,改变下列 条件,气体B的物质的量增大的是___。
a.缩小容器的容积
b.降低反应体系的温度
c.加入少量NaOH固体(生成物在此温度下不分解)
d.加入少量催化性能更好的催化剂
(6)金属镍(Ni)与气体A能形成常温下为液态的Ni(A)4、利用Ni(A)4的生成与分解可以制得纯度很高的纳米镍,写出Ni( A)4在423K时分解的化学方程式___。
参考答案:(1)I、Ⅱ、Ⅲ
(2)CO、HCl;CO2
(3)SiO2+Na2CO3 Na2SiO3+CO2↑
Na2SiO3+CO2↑
(4)反应体系中只有Si是固体,其他物质在1357?K下均为气体且在Si 中不溶解
(5)b
(6)Ni(CO)4 Ni+4CO↑
Ni+4CO↑
本题解析:
本题难度:一般
3、填空题 某小组对酸化及碱化膨润土负载镍催化CO2加氢甲烷化反应进行了研究。
(1)制备Ni-酸化膨润土、Ni-碱化膨润土的部分流程如下
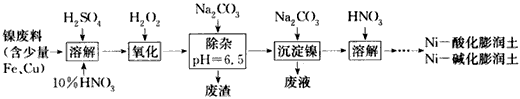
①“溶解”时维持反应温度为70-80℃,其目的是______________。
②“氧化”一步反应的离子方程式为_______________________。
(2)在不同温度下,膨润土、Ni-酸化膨润土、Ni-碱化膨润土催化CO2加氢甲烷化反应的结果如图所示:
a.Ni-碱化膨润土甲烷化选择性
b.Ni-酸化膨润士甲烷化选择性
c.膨润土甲烷化选择性
d.Ni-碱化膨润土CO2转化率
e.Ni-酸化膨润土CO2转化率
f.膨润土CO2转化率
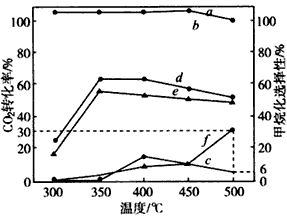
①在测定温度内,Ni-酸化膨润土对CO2加氢甲烷化反应的最适宜温度为____,理由是________________
②在相同温度下,对CO2的转化率,Ni-碱化膨润土高于Ni-酸化膨润土,原因可能是_______________。
③500℃时,在上述实验条件下向某装有膨润土的密闭容器中通入5 mol CO2和20 mol H2,充分反应后生成CH4的物质的量为__________。
参考答案:(1)①加快反应速率,同时防止温度过高HNO3分解和挥发;②2Fe2++H2O2+2H+=2Fe3++2H2O
(2)①350℃;该温度下甲烷化选择性为100%,且CO2转化率最高;②用碱处理的膨润土易吸附CO2
③0.09 mol
本题解析:
本题难度:困难
4、选择题 化石燃料是不可再生的,最终将会枯竭.基于我国目前的技术水平和管理水平,能源从开采、运输、加工到终端的利用效率都很低,浪费很大.据统计,开采效率为32%,加工运输效率为70%,终端利用率为41%,则总效率近似为( )
A.1.43%
B.14.3%
C.9.18%
D.91.8%
参考答案:C
本题解析:
本题难度:一般
5、填空题 某地有软锰矿和闪锌矿两座矿山,它们的组成如下:软锰矿:MnO2含量≥65 %,SiO2含量约为20%,
Al2O3含量约为4%,其余为水分;闪锌矿:ZnS含量≥ 80%,FeS、CuS、SiO2含量约为7%,其余为水分。科研人员开发了综合利用这两种资源的同槽酸浸工艺,工艺流程如下图所示。
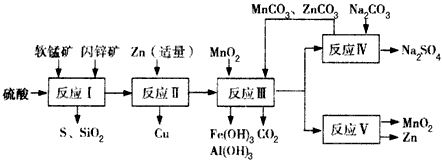
请回答下列问题:
(1)反应I后过滤所得滤液中含有MnSO4、ZnSO4、CuSO4、Fe2(SO4)3、Al2(SO4)3等。试写出反应I中生成
CuSO4的化学方程式_____________________。
(2)反应Ⅱ加入适量锌的作用是________________________。如果锌过量,还会进一步发生反应的离子方程式为________________________。
(3)反应V的条件是电解,电解时均用惰性电极,阳极发生的电极反应可表示为____________。
(4)本工艺所用的原料除软锰矿、闪锌矿、硫酸外还需要________等原料。
参考答案:(1)MnO2+CuS+2H2SO4=S+MnSO4+CuSO4+2H2O
(2)将溶液中的硫酸铜转化为铜;Zn+Fe2+ =Fe+Zn2+
(3)Mn2+-2e-+2H2O=MnO2+4H+
(4) Na2CO3、Zn、MnO2
本题解析:
本题难度:一般