微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 2009年《自然》杂志报道了我国科学家通过测量SiO2中26Al和10Be两种元素的比例确定“北京人”年龄的研究结果,这种测量方法叫“铝铍测年法”。 ?
完成下列填空:
(1)10Be和9Be_______。 ?
a.是同一种原子?b.具有相同的中子数 ?
c.具有相同的化学性质?d.具有恒定的丰度 ?
Be所在的周期中,最外层有2个未成对电子的元素相互组成的化合物属于_____晶体。
(2)Al和Be具有相似的化学性质,写出BeCl2水解反应的化学方程式_____。
(3)研究表明26Al可以衰变为26Mg,可以比较这两种元素金属性强弱的方法是____。?
a.比较这两种元素的单质的硬度和熔点 ?
b.在氯化铝和氯化镁的溶液中分别滴加过量的氢氧化钠溶液 ?
c.将打磨过的镁带和铝片分别和热水作用,并滴入酚酞溶液 ?
d.将空气中放置已久的这两种元素的单质分别和热水作用
(4)目前还有一种测量方法叫“钾氩测年法”。写出和Ar核外电子排布相同的阴离子的半径由大到小的顺序______(用化学符号表示);其中一种离子与钾相邻元素的离子所形成的化合物可用做干燥剂,此化合物的电子式是_______。
参考答案:(1)cd?;分子
(2)BeCl2+2H2O Be(OH)2+2HCl
Be(OH)2+2HCl
(3)bc
(4)S2->Cl-;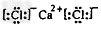
本题解析:
本题难度:一般
2、填空题 短周期的五种元素A、B、C、D、E,原子序数依次增大。A、B、C三种元素电子层数之和是5。A、B两元素原子最外层电子数之和等于C元素原子最外层电子数;B元素原子最外电子层上的电子数是它的电子层数的2倍,A与D可以形成原子个数比分别为1∶1和2∶1的两种液态化合物;E单质用于净化水质。
请回答:
(1)写出D在元素周期表中的位置 ?,?
E的原子结构示意图是 。?
下列可以验证C与D两元素原子得电子能力强弱的实验事实是 (填写编号)。?
A.比较这两种元素的气态氢化物的沸点
B.比较只有这两种元素所形成的化合物中的化合价
C.比较这两种元素的气态氢化物的稳定性
D.比较这两种元素的单质与氢气化合的难易
(2)由A、B两种元素组成的最简单的化合物,写出其电子式 。?
(3)均由A、B、C、D四种元素组成的甲、乙两种化合物,都既可以与盐酸反应又可以与NaOH溶液反应,甲为无机盐,其化学式为 ,乙为天然高分子化合物的水解产物,且是同类物质中相对分子质量最小的,其结构简式为 。?
(4)胶态磁流体在医学上有重要的用途,而纳米级Fe3O4是磁流体中的重要粒子,其制备过程可简单表示如下:
①将化合物CA3通入等物质的量的FeSO4、Fe2(SO4)3的混合溶液中,生成两种碱,写出该反应过程的总的离子方程式 ?。?
②上述反应生成的两种碱继续作用,得到Fe3O4。
(5)已知下表数据:
物质
| Fe(OH)2
| Fe(OH)3
|
Ksp/25 ℃
| 2.0×10-16
| 4.0×10-36
|
?
若使混合液中FeSO4、Fe2(SO4)3的浓度均为2.0 mol·L-1,则混合液中c(OH-)不得大于 mol·L-1。?
参考答案:(1)第二周期ⅥA族 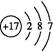 BCD
BCD
(2) 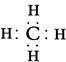
(3)NH4HCO3 或(NH4)2 CO3 H2NCH2COOH
(4)Fe2++2Fe3++8NH3+8H2O Fe(OH)2↓+2Fe(OH)3↓+8NH4+
Fe(OH)2↓+2Fe(OH)3↓+8NH4+
(5)10-12
本题解析:根据A、D可形成的两种液态化合物的情况知,这两种化合物为H2O和H2O2,再结合原子序数增大,所以A为H,D为O,则B只能为C,C为N,E单质可净化水质,E为Cl。
(1)O的原子序数是8,位于第二周期ⅥA族 ;氯元素位于第三周期ⅦA族,所以原子结构示意图为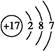 ;由气态氢化物的沸点无法确定元素的非金属性强弱。答案选BCD。
;由气态氢化物的沸点无法确定元素的非金属性强弱。答案选BCD。
(2)由A、B两种元素组成的最简单的化合物是甲烷,电子式为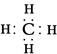 。
。
(3)都既可以与盐酸反应又可以与NaOH溶液反应,一般是弱酸的酸式盐或弱酸的铵盐或氨基酸,因此甲是碳酸氢铵或碳酸铵,乙是甘氨酸。化学式分别是NH4HCO3 或(NH4)2 CO3、H2NCH2COOH。
(4)①根据原子守恒可知,两种碱应该是氢氧化铁和氢氧化亚铁,所以方程式为Fe2++2Fe3++8NH3+8H2O Fe(OH)2↓+2Fe(OH)3↓+8NH4+。
Fe(OH)2↓+2Fe(OH)3↓+8NH4+。
(5)亚铁离子和铁离子的浓度分别是2.0 mol·L-1和4.0 mol·L-1,所以根据溶度积常数可知,相应OH-浓度分别是10-8 mol·L-1、10-12 mol·L-1,所以混合液中c(OH-)不得大于10-12 mol·L-1。
本题难度:一般
3、选择题 下列关于同主族元素的说法中错误的是( )
A.同主族元素随原子序数递增,元素原子失电子能力逐渐增强
B.同主族元素随原子序数递增,单质氧化性逐渐增强
C.同主族元素原子最外层电子数都相同
D.同主族元素的原子半径,随原子序数增大而逐渐增大
参考答案:A.同主族元素随原子序数递增,元素金属性增强,失电子能力增强,故A正确;
B.同主族元素随原子序数递增,元素的非金属性减弱,单质氧化性逐渐减弱,故B错误;
C.主族元素的族序数等于其最外层电子数,所以主族元素原子最外层电子数都相同,故C正确;
D.随原子序数增大而逐渐增大,主族元素的原子核外电子层数最多,原子半径增大,故D正确;
故选B.
本题解析:
本题难度:简单
4、推断题 X、Y、Z三种短周期元素,它们的原子序数之和为16。X、Y、Z三种元素常见单质在常温下都是无色气体,在适当条件下可发生如下图所示变化

已知一个B分子中含有的Z元素的原子个数比C分子中的少一个。请回答下列问题:
(1)X元素在周期表中的位置是______________________。
(2)X的单质与Z的单质可制成新型的化学电源(KOH溶液作电解质溶液),两个电极均由多孔性碳制成,通入的气体由孔隙中逸出,并在电极表面放电,则正极通入__________(填物质名称);负极电极反应式为____________________。
(3)C在一定条件下反应生成A的化学方程式是_______________________________。
(4)已知Y的单质与Z的单质生成C的反应是可逆反应,△H<0。将等物质的量的Y、Z的单质充入一密闭容器中,在适当催化剂和恒温、恒压条件下反应。下列说法中,正确的是____________________(填写下列各项的序号)。
a.达到化学平衡时,正反应速率与逆反应速率相等
b.反应过程中,Y的单质的体积分数始终为50%
c.达到化学平衡时,Y、Z的两种单质在混合气体中的物质的量之比为1:1
d.达到化学平衡的过程中,混合气体平均相对分子质量减小
e.达到化学平衡后,再升高温度,C的体积分数增大
参考答案:(1)第2周期,ⅥA族
(2)氧气;H2+2OH-==2H2O+2e-
(3)4NH3+5O2 4NO+6H2O
4NO+6H2O
(4)ab
本题解析:
本题难度:一般
5、填空题 (8分)非金属单质及其化合物在生产和科研中都有重要应用。
(1) 若发生大量氯气泄漏事故,下列措施中正确的是_________。?
a.立即通报相关部门,迅速撤离事故现场
b.用蘸有肥皂水的毛巾捂住口鼻立即逆风疏散
c.用蘸有NaOH溶液的毛巾捂住口鼻立即顺风疏散
(2) 事故发生后,可用NaOH稀溶液处理泄漏的氯气,反应的离子方程式是________。
(3) 向Na2SO3和Na2S的混合溶液中加入稀盐酸,溶液中会产生大量淡黄色沉淀。则该反应中氧化剂和还原剂的物质的量之比是__________
(4) Cl2与NO2在一定条件下发生化合反应,生成一种气体,实验数据如图。图中横坐标是加入C12的物质的量,纵坐标是反应后气体物质的量总和。已知所取C12、NO2的物质的量总和为6 mol。则生成物的化学式是__________。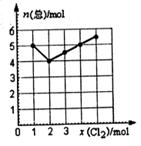
参考答案:(1)a、b(2分)(2)Cl2+2OH-=Cl-+ClO-+H2O(2分)(3)1:2(2分)(4)NO2Cl(2分)
本题解析:略
本题难度:简单