微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (12分)元素X、Y、Z、M、Q均为短周期主族元素,且原子序数依次增大。已知元素Y最高价氧化物对应水化物与它的氢化物反应能生成一种盐;Z原子最外层电子数与核外电子总数之比为3:4;M可与Z形成阴、阳离子个数比为1:2的两种化合物,Q原子的最外层电子数与次外电子数之比为3:4,YX3常温下为气体。
(1)化合物A、B由X、Z、M、Q四种元素中的三种组成的强电解质,且A属于碱,B属于盐,组成元素的原子数目之比均为1:1:1,则化合物A的化学式为?,B的化学式是?。
(2)Se是人体必备的微量元素,与Q同一主族。该族二至五周期元素单质分别与H2反应生成1mol 气态氢化物的反应热如下,表示生成1 mol哂化氢反应热(△H)的是?(填字母代号)。
A.+99.7kJ·mol-1?B.+29.7 kJ·mol-1
C.-20.6 kJ·mol-1?D.-241.8 kJ·mol-1
(3)X与Z、X与Q均可形成18电子分子甲和乙,写出甲、乙两种分子在水溶液中反
应生成Q单质的化学方程式?。X和Y也可形成18电子分子丙,它通常是一种液态火箭燃料。25℃、常压下,3.2g丙在氧气中完全燃烧放出热量为62.4kJ,请写出丙完全燃烧的热化学反应方程式?。
(4)X、Y两种元素形成的离子化合物的电子式为?。
参考答案:(1)NaOH、NaHS?(2)B
(3)H2O2+H2S=S+2H2O? H4N2(l)+O2(g)=2H2O(l)+N2(g)?△H=-624 kJ·mol-1(4)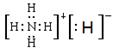
本题解析:Y最高价氧化物对应水化物与它的氢化物反应能生成一种盐,说明Y是N元素。Z原子最外层电子数与核外电子总数之比为3:4,因为最外层电子不能超过8个,所以Z最外层含有6个电子,是氧元素。M可与Z形成阴、阳离子个数比为1:2的两种化合物,则M是钠元素。Q原子的最外层电子数与次外电子数之比为3:4,因为最外层电子不能超过8个,所以Q得最外层含有6个电子,次外层有8个电子,在短周期元素中是硫元素。YX3常温下为气体,且X的原子序数最小,该该化合物是氨气,即X为氢元素。
(1)由H、O、Na、S四种元素中的三种组成的强电解质中属于强碱的是NaOH,属于盐的是NaHS。
(2)主族元素自上而下,非金属性逐渐减弱,与氢气化合的能力逐渐减弱,生成氢化物的稳定性逐渐减弱,所以放热逐渐减少,而吸热逐渐增多,因为硒是第四周期元素,所以选B。
(3)H与O、H与S形成的18电子分子分别为H2O2、H2S。前者具有强氧化性可将硫化氢氧化生成单质硫,方程式为H2O2+H2S=S+2H2O。H与N形成的18电子是H4N2,所以热化学方程式为H4N2(l)+O2(g)=2H2O(l)+N2(g)?△H=-624 kJ·mol-1。
(4)N与H元素形成的离子化合物是NH4H,其中阳离子是NH4+,阴离子是H-。电子式为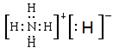 。
。
本题难度:简单
2、简答题 已知A、B、D为中学常见的气体单质,甲、乙、丙、丁为常见的化合物,甲的水溶液呈碱性.它们之间有如下所示转化关系(部分产物及反应条件已略去)
请完成下列空白:
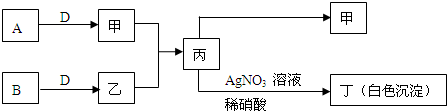
(1)乙的名称为______,丙转化为丁的离子方程式为______
(2)实验室可通过多种方法制备甲,用如图所示装置收集甲,下列关于制取及收集甲实验的叙述中,正确的是______(填序号)
①甲气体不能用排水法收集
②实验室用丙一种药品可以制取甲
③图中的a为浸有稀H2SO4的棉花
④可用甲的浓溶液和生石灰为原料制取甲
(3)工业上通常以甲为原料制备HNO3.硝酸工业尾气中的NO和NO2对环境有污染,可用NaOH溶液吸收.尾气中NO与NO2按物质的量之比1:1被NaOH溶液吸收得到一种钠盐,该反应的化学方程式为______.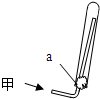
参考答案:甲是由A、D气体单质形成的化合物,水溶液呈碱性,应为NH3,丙中加入硝酸银生成白色沉淀,该沉淀不溶于硝酸,应为AgCl,则丙为NH4Cl,由此可知乙为HCl,则A为N2,B为Cl2,D为H2,
(1)由以上分析可知乙为氯化氢,丙为氯化铵,与硝酸酸化的硝酸银发生:Ag++Cl-=AgCl↓,
故答案为:氯化氢;Ag++Cl-=AgCl↓;
(2)①甲气体极易溶于水,不能用排水法收集,故①正确;
②氯化铵加热易分解,但生成的氨气和氯化氢和重新生成氯化铵,不能用加热氯化铵的方法制备氨气,应用氯化铵和氢氧化钙固体制备,故②错误;
③氨气易与酸反应,用干燥的棉花的密度是防止氨气逸散和与空气对流,但不能用浸有稀H2SO4的棉花,故③错误;
④生石灰可与水反应,丙放热,可促进氨气的挥发,则可用氨气的浓溶液和生石灰为原料制取氨气,故④正确,
故答案为:①④;
(3)发生反应为归中反应,根据N元素的化合价可知应生成NaNO2,反应的方程式为NO+NO2+2NaOH=2NaNO2+H2O,
故答案为:NO+NO2+2NaOH=2NaNO2+H2O.
本题解析:
本题难度:一般
3、填空题 现有金属单质A、B和气体甲、乙、丙及物质C、D、E、F、G,它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出).
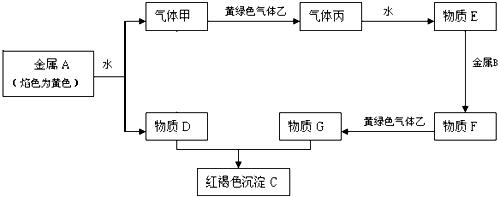
①
请根据以上信息回答下列问题:
(1)写出下列物质的化学式:乙______?丙______?F______;
(2)写出下列反应的化学方程式或离子方程式:
①金属A和水反应的离子方程式______;
②物质E和金属B反应的离子方程式______;
③物质D和G反应的化学方程式______.
参考答案:黄绿色气体为Cl2,则与Cl2反应的气体甲为H2,丙为HCl,物质E为盐酸,金属A与水反应生成的为碱为NaOH,D为NaOH,盐酸与金属B反应,生成的产物F还能继续与氯气反应,则金属B为变价金属,应为Fe,所以F为FeCl2,G为FeCl3,C为Fe(OH)3;
(1)由以上分析可知,乙为Cl2,丙为 HCl,F为FeCl2;故答案为:Cl2; HCl;FeCl2;
(2)①金属A为钠和水反应的离子方程式:2Na+2H2O=2Na++2OH-+H2↑
②物质E为盐酸,和金属B为Fe反应的离子方程式:Fe+2H+=Fe2++H2↑
③物质DNaOH和GeCl3反应的化学方程式:3NaOH+FeCl3=Fe(OH)3↓+3NaCl
故答案为:2Na+2H2O=2Na++2OH-+H2↑;Fe+2H+=Fe2++H2↑;3NaOH+FeCl3=Fe(OH)3↓+3NaCl
本题解析:
本题难度:一般
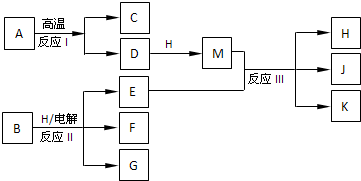
4、简答题 如图所示反应Ⅰ、反应Ⅱ和反应Ⅲ均是工业生产中常见的反应.其中A、B为化合物,C是温室气体之一,D和K均可用做干燥剂,H常温下为液态化合物,J是一种具有漂白作用的盐,反应Ⅲ和E与G反应的原理相同.
(1)C与J的水溶液反应后生成的含氧酸的电子式是______.
(2)E与G反应的离子方程式是______.
(3)J久置后,即便不接触水、空气,本身也逐渐分解生成K,并放出气体,该反应的化学方程式是______.
(4)工业上测定反应III产品的有效成分J的含量,先将一定量的产品的溶液加入过量的KI溶液和稀硫酸中,使之反应生成I2,然后用Na2S2O3标准溶液滴定I2,计算出结果.
①用Na2S2O3标准溶液滴定I2时选用的指示剂是______.
②生成I2的反应的离子方程式是______.
参考答案:反应I、反应II和反应III均是工业生产中常见的反应,A、B为化合物,C是温室气体之一为CO2,D和K均可用做干燥剂结合反应条件判断为D为CaO,A为CaCO3,H常温下为液态化合物推断为H2O,M为Ca(OH)2,J是一种具有漂白作用的盐推断为Ca(ClO)2,K为CaCl2,E为Cl2,反应III和E与G反应的原理相同,说明G为碱,结合反应条件,可以推断B为NaCl,电解溶液反应生成产物G为NaOH,F为H2;
(1)C(CO2)与J(Ca(ClO)2)的水溶液反应生成碳酸钙和含氧酸次氯酸,次氯酸的电子式是:
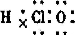
;故答案为:
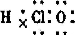
;
(2)E(Cl2)与G(Ca(OH)2)反应的离子方程式:Cl2+2OH-=Cl-+ClO-+H2O,故答案为:Cl2+2OH-=Cl-+ClO-+H2O;
(3)J(Ca(ClO)2)久置后,即便不接触水、空气,本身也逐渐分解生成K(CaCl2),并放出气体氧气,该反应的化学方程式:Ca(ClO)2=CaCl2+O2↑,故答案为:Ca(ClO)2=CaCl2+O2↑;
(4)①用Na2S2O3标准溶液滴定I2时选用的指示剂淀粉,随着Na2S2O3标准溶液的滴入,蓝色褪去;
②生成I2的反应的离子方程式为:ClO-+2I-+2H+=Cl-+I2+H2O;
故答案为:淀粉溶液;ClO-+2I-+2H+=Cl-+I2+H2O.
本题解析:
本题难度:一般
5、简答题 X、Y、Z是短周期元素的三种常见氧化物.X跟水反应后可生成一种具有还原性的不稳定的二元酸,该酸的化学式是______;Y和X的组成元素相同,Y的化学式是______;1mol?Z在加热时跟水反应的产物需要用6mol的氢氧化钠才能完全中和,在一定条件下,Y可以跟非金属单质A反应生成X和Z,单质A是______.
参考答案:还原性的不稳定的二元酸是H2SO3,所以X是SO2,与之组成元素相同的是SO3,故Y为SO3;和热水反应生成酸要6mol一元碱中和,说明是2mol三元酸(没有符合条件的六元酸),也就是H3PO4,因此Z是P4O10(简写P2O5),则A是磷.
故答案为:H2SO3;SO3;磷.
本题解析:
本题难度:一般