微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数依次增大。其中A原子核外有三个未成对电子;A与B可形成离子化合物B3A2;C元素是地壳中含量最高的金属元素;D原予核外的M层中有两对成对电子;E原子核外最外层只有1个电子,其余各层电子均充满。请根据以上信息,回答下列问题:? (答题时,A、B、C、D、E用所对应的元素符号表示)
(1)E的核外电子排布式是?,A、B、C、D的第一电离能由小到大的顺序为?。
(2)B的氯化物的熔点远高于C的氯化物的熔点,理由是?;
(3)A的最高价含氧酸根离子中,其中心原子采取?杂化,D的低价氧化物分子的空间构型是?。
(4)A、E形成某种化合物的晶胞结构如下图所示,则其化学式为?;(每个球均表示1个原子)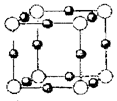
参考答案:(1)1s22s22p63s23p63d104s1(或[Ar] 3d104 s1)? A1<Mg<S<N
(2)MgCl2为离子晶体而A1C13为分子晶体? (3)sp2,V形? (4)Cu3N
本题解析:根据元素的结构及有关性质可知,A、B、C、D、E分别是N、Mg、Al、S、Cu。
(1)根据构造原理可知,铜原子的核外电子排布式是1s22s22p63s23p63d104s1(或[Ar] 3d104 s1) ;非金属性越强,第一电离能越大,所以四种元素的第一电离能大小顺序是A1<Mg<S<N。
(2)由于MgCl2为离子晶体,而A1C13为分子晶体,所以前者的熔点远高于后者。
(3)NO3-中氮原子能源孤对电子,所以其结构是平面三角形结构,氮原子是sp2杂化。由于SO2分子中,S原子含有2对孤对电子,所以SO2是V形结构。
(4)根据晶胞的结构可知,含有的氮原子是8×1.8=1,而含有的铜原子是12×1/4=3,所以该化合物的化学式是Cu3N。
本题难度:一般
2、填空题 Q、R、X、Y、Z五种元素的原子序数依次递增.已知:
①Z元素的正三价离子的3d轨道为半充满,其余的均为短周期主族元素;
②Y原子价电子(外围电子)排布msnmpn;
③R原子核外L层电子数为奇数;
④Q、X原子p轨道的电子数分别为2和4.
请回答下列问题:
(1)Z元素基态原子的外围电子排布式为______.
(2)五种元素中,电负性最大与最小的两种非金属元素形成的物质的化学式为______.
(3)Q、R、X三种元素的第一电离能数值由小到大的顺序为______(用元素符号作答).
(4)Z元素的正三价离子的硝酸盐水溶液显______性,试用离子方程式解释其原因:______
(5)Q的一种氢化物组成18电子的分子,其化学式(分子式)为______.
参考答案:Q、R、X、Y、Z五种元素的原子序数依次递增.Z元素的正三价离子的3d轨道为半充满,其余的均为短周期主族元素,则Z原子的外围电子排布为3d64s2,故Z为Fe;Y原子价电子(外围电子)排布msnmpn,由于s能级只能容纳2个电子,故n=2,Y处于ⅣA族;R原子核外L层电子数为奇数,L层未排满电子,则R处于第二周期;Q、X原子p轨道的电子数分别为2和4,原子核外电子排布分别为1s22s2sp2、1s22s2sp4,故Q为C元素、X为O元素,结合原子序数可知,R为N元素、Y为Si元素,
(1)Z元素的正三价离子的3d轨道为半充满,则基态Z原子的外围电子排布为3d64s2,
故答案为:3d64s2;
(2)五种元素中,电负性最大的非金属性元素为O元素,电负性最小的非金属性元素为Si,二者形成的物质为SiO2,
故答案为:SiO2;
(3)C、N、O三种元素同周期,第一电离能呈增大趋势,但氮元素2p能级容纳3个电子为半满稳定状态,第一电离能高于氧元素,故第一电离能数值由小到大的顺序为C<O<N,
故答案为:C<O<N;
(4)Fe元素的正三价离子的硝酸盐水溶液中Fe3+离子水Fe3++3H2O?Fe(OH)3+3H+,破坏水的电离平衡,溶液呈酸性,
故答案为:酸;Fe3++3H2O?Fe(OH)3+3H+;
(5)C(碳)元素的一种氢化物组成18电子的分子,其化学式(分子式)为C2H6,
故答案为:C2H6.
本题解析:
本题难度:一般
3、选择题 A、B、C、D、E是同一周期的五种主族元素,A和B的最高价氧化物对应的水化物显碱性,且碱性B>A;C、D两种元素对应气态氢化物的稳定性C>D;E是这五种元素中形成简单离子半径最小的元素.则它们的原子序数由小到大的顺序为( )
A.D<C<E<A<B
B.A<B<C<D<E
C.E<B<A<C<D
D.B<A<E<D<C
参考答案:因A、B、C、D、E是同一周期的五种主族元素,A和B的最高价氧化物对应的水化物显碱性,且碱性B>A,
则金属性B>A,
C、D两种元素对应气态氢化物的稳定性C>D,则非金属性C>D,
由同周期元素从左到右,元素的金属性减弱,非金属性增强,
则A、B、C、D的原子序数由小到大的顺序为B<A<D<C,
又E是这五种元素中形成简单离子半径最小的元素,A、B、E均为金属,具有相同的电子排布,
根据离子半径的比较规律:径小序大,则三者中E的原子序数最大,
所以五种元素的原子序数由小到大的顺序为B<A<E<D<C,
故选D.
本题解析:
本题难度:一般
4、填空题 氮、磷、砷是同族元素,该族元素单质及其化合物在农药、化肥生产等方面有重要应用。请回答下列问题:
(1)砷原子的核外电子排布式为_____________________________________。
(2)K3[Fe(CN)6]晶体中Fe3+与CN-之间的键型为________,该化学键能够形成的原因是______________________________________________________。
(3)NH4+中氮原子的杂化类型为________,NH4+的空间构型为________。
(4)已知:
?
| CH4
| SiH4
| NH3
| PH3
|
沸点(K)
| 101.7
| 161.2
| 239.7
| 185.4
|
分解温度(K)
| 873
| 773
| 1 073
| 713.2
|
?
分析上表中四种物质的相关数据,请回答:
CH4和SiH4比较,NH3和PH3比较,沸点高低的原因是___________________________________________________________________________。
CH4和SiH4比较,NH3和PH3比较,分解温度高低的原因是_________________________________________________________________________。
结合上述数据和规律判断,一定压强下HF和HCl的混合气体降温时________先液化。
(5)电负性(用X表示)也是元素的一种重要性质,下表给出8种元素的电负性数值:
元素
| Na
| Mg
| Al
| Si
| P
| S
| Cl
| K
|
电负性
| 0.9
| 1.2
| 1.5
| 1.8
| 2.1
| 2.5
| 3.0
| 0.8
|
?
请回答下列有关问题:
估计钙元素的电负性的取值范围:________<X<________。经验规律告诉我们:当形成化学键的两原子相应元素的电负性差值大于1.7时,所形成的一般为离子键;当小于1.7时,一般为共价键。试推断AlCl3中形成的化学键的类型及其理由:__________________________。
参考答案:(1)1s22s22p63s23p63d104s24p3
(2)配位键 CN-能提供孤对电子,Fe3+能接受孤对电子(或Fe3+有空轨道)
(3)sp3 正四面体形
(4)①组成和结构相似时,相对分子质量越大,分子间作用力越大,因此SiH4沸点高于CH4;NH3分子间还存在氢键作用,因此NH3的沸点高于PH3
②C—H键键能大于Si—H键,因此CH4的分解温度高于SiH4的;N—H键键能大于P—H键,因此NH3的分解温度高于PH3的 HF
(5)①0.8 1.2 ②共价键;因为Cl与Al的电负性差值为1.5,小于1.7
本题解析:(1)砷为33号元素,位于第四周期ⅤA族,则可写出其原子核外电子排布式。(2)K3[Fe(CN)6]为配位化合物,其中Fe3+与CN-之间的化学键为配位键,Fe3+有空轨道,而CN-有孤对电子,所以二者可以形成配位键。(3)NH4+中的N原子是中心原子,杂化方式是sp3;NH4+的结构类似于CH4,为正四面体结构。(4)NH3分子间存在氢键,故其沸点比相对分子质量大的PH3高。(5)钙与钾同周期,故其电负性比钾大,与镁同主族,故其电负性比镁小;Al与Cl的电负性差为1.5<1.7,所以AlCl3中的化学键为共价键。
本题难度:一般
5、选择题 X与Y两元素的单质能化合生成XY型的离子化合物,则X、Y可能属于(? )
A.ⅠA族和ⅣA族
B.ⅡA族和ⅥA族
C.ⅠA族和ⅦA族
D.ⅥA族和ⅦA族
参考答案:BC
本题解析:ⅠA、ⅡA中有活泼的金属,ⅥA、ⅦA中有活泼的非金属,形成离子型化合物的一般是活泼金属与活泼非金属。
本题难度:简单