微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 碳酸钙常用作牙膏的摩擦剂.某同学设计了一种制备碳酸钙的方案,其流程图如下.(所用石灰石含有杂质SiO2)

回答下列问题:
(1)充分煅烧110吨石灰石得到固体66吨.标准状况下生成二氧化碳的体积为______L,石灰石中碳酸钙的质量分数为______%.
(2)假设第①步反应完全进行,则第②步反应过滤后得到的不溶液性滤渣的成分为______.
(3)第③步反应一般不采用通入CO2的主要原因是______,相应的离子方程式为______.
(4)CaCO3是一种难溶液物质,25℃时其KSP=2.8×10-9.现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2.0×10-4mol/L,则生成沉淀所需CaCl2溶液的物质的量浓度最小是______.
(5)某生用石灰石为原料,设计了另一种制备碳酸钙的实验方案,其流程图如下
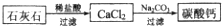
与前一方案相比较,该方案的优点是______.
参考答案:(1)根据碳酸钙分CaCO3 ?高温?.??CaO+CO2↑△m
? 100?56?44? 44
?100×106g? 44×106?g? 44×106g
? 所以生成二氧化碳的体积为44×10644mol×22.4L/mol=2.24×107 L,
?石灰石中碳酸钙的质量分数为100×106110×106× 100%=90.9%
? 故答案为:2.24×107? 90.9?
? (2)碳酸钙除了分解,还与SiO2发生反应:SiO2+CaCO3 =CaSiO3+CO2SiO2+CaCO3?高温?.? CaSiO3+CO2↑,所以SiO2+CaCO3 =CaSiO3+CO2不溶液性滤渣的成分
CaSiO3,故答案为:CaSiO3;
SiO2+CaCO3 =CaSiO3+CO2
? (3)因CO2过量时,会继续与碳酸钙反应,
故答案为:通入CO2的量不易控制,使生成的碳酸钙在CO2过量的条件下溶解;CaCO3+CO2+H2O═Ca2++2HCO3-
?(4)因QC≥KSP时,形成沉淀,C(Ca2+)≥2.8×10-91×10-4mol?L-1=2.8×10-5mol?L-1,等体积混合前CaCl2溶液的物质的量浓度最小为5.6×10-5 mol?L-1,故答案为:5.6×10-5 mol?L-1
? (5)因与前一方案相比较,可知制备过程不需要加热、操作简便等,故答案为:不需要加热,操作简便,减少来自燃料的污染
本题解析:
本题难度:一般
2、实验题 铜和稀硝酸在常温常压下反应,开始时反应非常慢,但是随着反应的进行,反应速率不断地加大。某校合作学习小组的同学拟探究影响其速率的主要因素。
(1)甲同学认为是生成的Cu2+对该反应起催起作用,欲验证其假设是否正确,其实验方法是_________________________________。
(2)乙同学依据铜和硝酸是放热反应,拟研究温度升高是否为该反应速度率不断加大的主要原因,实验结果如下
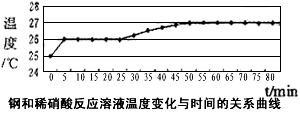
由此可得出的结论是:_____________________________。
(3)丙同学查阅文献,得知稀硝酸与铜反应,还原产物起始也是NO2,NO2对该反应起催化作用。通过下列装置验证。实验发现左侧3min后开始大量产生气泡,右侧40min内无明显变化。
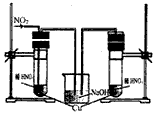
①氢氧化钠溶液的作用是_______________________。
②该学生设计在左侧加的是2mol·L-1 HNO3溶液,右侧加的是2.2mol·L-1硝酸。左侧浓度稍偏小,这样设计主要是考虑到______________________。
(4)丁同学与丙同学交流后,他将实验改进为:在试管中加入3mL2mol·L-1HNO3并放入铜片,然后加入几粒NaNO2晶体,发现只需1秒钟,铜片表面就开始产生气泡。由丁的实验可得出的结论是_________________________________。
参考答案:(1)取两去试管分别加入同浓度的稀硝酸和相同的铜片,在其中一支中加入少量硫酸铜晶体,比较两者开始产生气泡的时间
(2)80min内温度只上升了2℃,说明温度变化不是主要原因
(3)①吸收氮的氧化物,防止污染环境;②左侧通入NO2时,一部分NO2与水反应会生成硝酸,使硝酸浓度变大。
(4)NO2催化机理可能是在反应中得电子生成NO2-起催化作用(NO2-对该反应也能起催化作用)。
本题解析:
本题难度:困难
3、实验题 (16分)配 制200mL0.5 mol·L-1的NaOH溶液,请回答下列问题:
制200mL0.5 mol·L-1的NaOH溶液,请回答下列问题:
Ⅰ、请将下述实验步骤中缺少的文字请补充完整
(1)实验中选用的仪器除托盘天平、砝码、镊子、量筒、玻璃棒外还必须用到?
??仪器。
(2)计算:所需NaOH的质量为??g;
(3)称量:用托盘天平称量时,首先将托盘天平调平,将 ?放在天平的左盘上称量其质量,再添上?g砝码后,向左盘加NaOH固体到平衡为止;
(4)溶解:向盛有NaOH的烧杯中加入70mL水并用玻璃棒?使其溶解;
(5)转移:将步骤(4)中溶液用玻璃棒 ?注入容量瓶中,在烧杯中加入少量的水,小心洗涤2—3次后并将洗涤液移入容量瓶中 ;
(6)定容:继续往容量瓶中加水至液面接近刻度线? cm处,改用?加水至刻度线,注意视线与??保持水平,加盖摇匀。
(7)贮存: 将溶液倒入试剂瓶中保存,贴上标签注明溶液的浓度和配制日期。
参考答案:(8分)
Ⅰ、(1)250mL容量瓶?胶头滴管?小烧杯 药匙(3分,答前三个即得3分)
(2)5.0 (写小数点后一位给2分)
(3)小烧杯(1分)? 5.0(1分)?(4)搅拌(1分)?(5)引流(1分)
(6)1~2cm?(1分)胶头滴管(1分) 刻度线(1分)
Ⅱ、误差分析:偏高?无影响?偏低?偏高(各1分)
本题解析:略
本题难度:一般
4、选择题 下列实验中,能够达到预期目的的是(? )
编号
| 实验内容
| 实验目的
|
A
| 在Na2SO3溶液中加入HNO3酸化的Ba(NO3)2 ,产生白色沉淀
| 检验Na2SO3是否变质
|
B
| 将某气体通入品红溶液中,品红褪色
| 证明该气体是SO2
|
C
| 用洁净的玻璃棒蘸取NaOH溶液,点在湿润的pH试纸上,与标准比色卡对照
| 测定NaOH溶液的pH
|
D
| 在两支试管中各加入4 mL? 0.01 mol/L的KMnO4 酸性溶液,再分别加入0.1 mol/L H2C2O4 溶液2 mL、0.2 mol/L H2C2O4 溶液2 mL, 分别记录溶液褪色所需时间
| 探究相同条件下,溶液浓度对反应速率的影响
参考答案:D
本题解析:A项:HNO3首先氧化Na2SO3成Na2SO4,Na2SO4再与Ba(NO3)2反应产生白色沉淀;B项:氯气也可以使品红溶液褪色;若将某气体通入品红溶液中,品红褪色,再加热颜色恢复,可证明该气体是SO2;C项:pH试纸使用时不用湿润。故选D。
点评:解答本题需主要学生对实验操作细节的掌握,要求学生平时注意基础知识的积累掌握(PH的使用前不能湿润。Na2SO3具有还原性,HNO3具有强氧化性)。
本题难度:简单
5、实验题 实验室常用下列装置来进行铜跟浓硫酸反应等一系列实验。
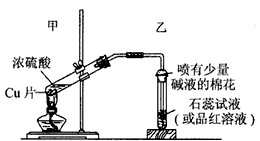
(1)根据什么现象可判断铜跟浓硫酸反应有SO2生成 ___。根据什么现象可判断铜跟浓硫酸反应有硫酸铜生成____ 写出甲装置中发生的主要反应的化学方程式:___。
(2)你在实验室中进行这个实验时,除了(1)小题中指出的实验现象外,还可以观察到许多其他的实验现象,请写出两种:____,____ 。
(3)右边的试管口部放有一团浸有碱液的棉花,棉花中通常是浸有饱和碳酸钠溶液,写出棉花中发生反应的化学方程式___。
参考答案:(1)品红溶液褪成无色 ;反应后试管中的混合物倒入冷水中稀释可得蓝色溶液 ;
Cu+2H2SO4(浓) CuSO4 +SO2↑+2H2O CuSO4 +SO2↑+2H2O
(2)反应中试管内溶液变黑色浑浊 ;反应试管上部有白雾 ;反应开始时铜片表面变黑并有气泡产生等
(3)Na2CO3+SO2=Na2SO3+CO2
本题解析:
本题难度:一般
|