微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 (16分)小苏打(NaHCO3)试样中含有碳酸钠晶体(Na2CO3·10H2O),为测定试样中小苏打的质量分数ω(NaHCO3),实验小组同学设计了如下装置进行实验。

[实验过程]
①按图组装仪器,检查装置的气密性;
②将m1g试样放入硬质玻璃管中,装置B、C、D 中药品如图,己知加药品后装置B的质量为m2 g装置C 的质量为m3g;
③关闭活塞a,点燃酒精灯加热试样,直到B 装置中无气泡冒出后,打开活塞a 向装置中通人N2,一段时间后,撤掉酒精灯,关闭活塞a;
④称得装置B 的质量为m4g、装置C 的质量为m5g。
请回答以下问题(装置中原有空气对实验的影响忽略不计):
⑴装置A中发生反应的化学方程式为____________________________________
⑵装置B的作用为__________________________________________
装置C的作用为________________________________________________
⑶实验过程中通入N2的目的为__________________________________________
⑷用下列各项所提供的数据能计算出ω(NaHCO3)的是____________(填选项字母)。
序号
| a
| b
| c
| d
| e
|
数据
| m1、m2、m3
| ? m2、m3、
m4、m5
| m1、m2、m4
| m1、m4、m5
| m1、m3、m5
|
⑸实验结束后发现装置A 中硬质玻璃管右端有水珠,你认为利用实验中所提供的数据还能否得到准确的ω(NaHCO3),若能,则ω(NaHCO3)的计算式为:__________________;若不能,此问不作答。
参考答案:⑴2NaHCO3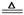 Na2CO3 + CO2 + H2O (2分)、Na2CO3·10H2O
Na2CO3 + CO2 + H2O (2分)、Na2CO3·10H2O  Na2CO3 + 10 H2O (2分)
Na2CO3 + 10 H2O (2分)
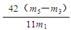
⑵吸收反应生成的水蒸气(2分) ;吸收反应生成的CO2 (2分);
⑶把装置中的CO2和水蒸气排出被装置B和装置C吸收(2分)
⑷b、c 、e? (3分)?;
(5)×100% (3分)
本题解析:(1)装置A中,样品中的NaHCO3受热分解产生CO2、H2O、Na2CO3;Na2CO3·10H2O受热失去结晶水,据此可写出反应方程式。
(2)装置B中的浓硫酸能吸收样品分解产生的水蒸气,装置C中的碱石灰能吸收样品分解产生的CO2。
(3)由于受热分解后,装置中含有CO2、水蒸气,通入N2能将装置中的CO2、H2O排出而被装置C、B吸收,从而降低实验误差。
(4)根据实验原理,样品分解产生的CO2只能被装置c吸收,根据(m5-m3)的质量这个得出分解的NaHCO3的质量,也可得出分解产生的H2O的质量,再根据(m4-m2)的质量并结合NaHCO3分解产生H2O的质量,则可得出Na2CO3·10H2O的质量,为此可得出样品总质量和NaHCO3的质量,从而计算出NaHCO3的质量分数,所以b组数据能计算出NaHCO3质量分数;由m1样品质量和(m2-m4)的质量可得出NaHCO3的质量,从而可计算出NaHCO3的质量分数,故c组数据能计算出NaHCO3质量分数;有m1的样品质量和(m5-m3)的质量可得出NaHCO3的质量,从而可计算出NaHCO3的质量分数,故e组数据能计算出NaHCO3质量分数,但a、d组数据不能计算出NaHCO3质量分数。
(5)选择e组数据计算则与A装置中的水珠无关,根据反应2NaHCO3 Na2CO3+CO2↑+ H2O,生成CO2的质量=(m5-m3)g,则m1g 样品中NaHCO3的质量=
Na2CO3+CO2↑+ H2O,生成CO2的质量=(m5-m3)g,则m1g 样品中NaHCO3的质量= ,故
,故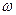 (NaHCO3)=
(NaHCO3)=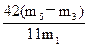 ×100%。
×100%。
本题难度:一般
2、实验题 (10分)氮化铝(AlN)是一种新型的无机非金属材料,工业上由氧化铝与焦炭在氮气流中高温制得。请回答下列有关问题。
(1)氮化铝 (AlN)制备:Al2O3+N2+3C
(AlN)制备:Al2O3+N2+3C 2AlN+3CO,反应中氧化产物与还原产物的物质的量之比为?。
2AlN+3CO,反应中氧化产物与还原产物的物质的量之比为?。
(2)AlN产品中常含有Al4C3、碳和Al2O3等杂质,已知Al4C3与水反应生成CH4,CH4与CuO发生反应:
CH4+4CuO CO2+2H2O+4Cu。为测定产品中有关成分的含量,所需仪器如下:
CO2+2H2O+4Cu。为测定产品中有关成分的含量,所需仪器如下:

【测定样品中Al4C3的含量】
若各装置连接的顺序为:A→C→F→C→D→E,请补充操作步骤:
①称量D的质量,按顺序组装仪器,检查装置的气密性,将试样放入锥形瓶中;
②?;③?;④?;⑤?;⑥再次称量D的质量;
⑦重复步骤⑤和⑥的操作,直到D的质量基本不变。
【测定AlN的含量】
已知AlN能够水解,请选择合适的药品和装置,按气流方向连接各装置,其顺序为:
?→?→?→E。若试样为mg ,测得C增重n g,则AlN的质量分数是?。
参考答案:

本题解析:略
本题难度:一般
3、填空题 (12分).现有含NaCl、Na2SO4和NaNO3的混合物,选择适当的试剂将其转化为相应的沉淀或固体,从而得到较为纯净的NaNO3。实验流程可用下图表示:
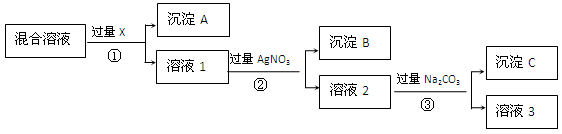
请回答下列问题:
(1)写出实验流程中下列物质的化学式:
试剂X:?,沉淀B:?。
(2)实验流程中加入过量的Na2CO3的目的是?。
(3)实验方案得到的溶液3中肯定含有?(填化学式)杂质;为了解决这个问题,可以向溶液3中加入适量的?,请写出所发生反应的离子方程式_______________。
参考答案:(1) BaCl2或Ba(NO3)2、AgCl (2) 使溶液中的Ag+、Ba2+完全沉淀(3) Na2CO3、稀HNO3、2H++CO32-==H2O+CO2↑
本题解析:略
本题难度:一般
4、实验题 铝镁合金已成为轮船制造、化工生产等行业的重要材料。研究性学习小组为测定某含镁3%一5%的铝镁合金(不含其它元素)中镁的质量分数,设计以下实验方案进行探究。填写下列空白。?
[实验方案]铝镁合金粉末 测定剩余固体质量
测定剩余固体质量
[实验步骤]
步骤1:称取5.4g铝镁合金粉末样品,投入VmL 2.0mol·L—1NaOH溶液中,充分反应。
步骤2:过滤、洗涤、干燥、称量固体。
[交流与讨论]
(1) 实验中发生反应的化学方程式是?;
(2)参与反应的NaOH溶液的体积V≥?;
(3)步骤2中,如果经两次过滤滤液仍浑浊,则原因可能是_________(只填一点);
(4)步骤2中,若未洗涤固体,测得镁的质量分数将?(填“偏高”或“偏低”)。
[实验拓展] 请你另设计一个实验方案(用上述方案的试剂),测定该铝镁合金中镁的质量分数。
要求:从下图中挑选所需的仪器,画出该方案的实验装置简图(添加必要的塞子、玻璃导管、胶皮管,固定装置不用画),并标明所用试剂.

参考答案:[交流与讨论](1)2Al+2NaOH+2H2O=2NaAlO2+3H2 ↑? (2)97mL?
(3)滤纸破损;过滤时漏斗里的液面高于滤纸边缘;仪器不干净等
(4)偏高
[实验拓展] 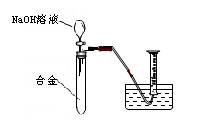
本题解析:
本题考查镁铝合金中镁的质量分数的测定。(1)金属铝与氢氧化钠反应生成氢气;(2)极值法考虑,设5.4g合金中含有镁的量为3%,则金属铝的物质的量为: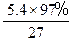 mol=0.194mol,需要氢氧化钠的物质的量为0.194mol,体积为:
mol=0.194mol,需要氢氧化钠的物质的量为0.194mol,体积为: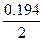 L=0.097L;(3)滤液仍浑浊,说明滤液中仍然有金属镁,过滤操作有误;(4)若没有洗涤,则镁的质量偏大,所得质量分数也偏高。
L=0.097L;(3)滤液仍浑浊,说明滤液中仍然有金属镁,过滤操作有误;(4)若没有洗涤,则镁的质量偏大,所得质量分数也偏高。
本题难度:一般
5、实验题 (15分)氰化物有剧毒,冶金工业会产生大量含氰化物的废水,其中氰化物以CN—等形式存在于废水中。某化学小组同学对含氰化物废水处理进行研究。
I.查阅资料:含氰化物的废水破坏性处理方法。
利用强氧化剂将氰化物氧化为无毒物质,如以TiO2为催化剂用NaClO将CN-离子氧化成CNO-(CN-和CNO-中N元素均为-3价),CNO-在酸性条件下继续与NaClO反应生成N2、CO2、Cl2等。
II.实验验证:破坏性处理CN-的效果。
化学兴趣小组的同学在密闭系统中用图10装置进行实验,以测定CN-被处理的百分率,实验步骤如下:
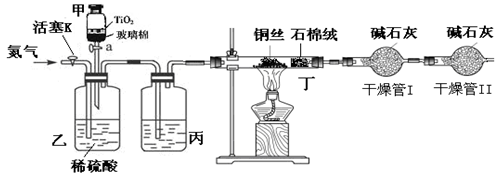
步骤1:取一定量废水进行加热蒸发、浓缩。
步骤2:取浓缩后含CN-离子的废水与过量NaClO溶液的混合液共200mL(设其中CN-的浓度为0.2mol·L—1)倒入甲中,塞上橡皮塞。
步骤3:?
步骤4:打开甲上的橡皮塞和活塞,使甲中溶液全部放入乙中,关闭活塞。
步骤5:打开活塞K,通一段时间N2,关闭活塞K。
步骤6:实验完成后测定干燥管I(含碱石灰)的质量m2(实验前干燥管I(含碱石灰)的质量m1)
回答下列问题:
(1)在破坏性处理方法中,在酸性条件下NaClO和CNO-反应的离子方程式?。
(2)完成步骤3?。
(3)丙装置中的试剂是?,丁装置的目的是?。
(4)干燥管Ⅱ的作用是?。
(5)请简要说明实验中通入N2的目的是?。
(6)若干燥管Ⅰ中碱石灰增重1.408g,则该实验中测得CN-被处理的百分率为?。
参考答案:(1)2CNO—+6ClO—+8H+=2CO2↑+N2↑+Cl2↑+4H2O?(2分)
(2)点燃酒精灯对丁装置加热(2分)?(3)浓硫酸;除去Cl2(各2分)
(4)防止空气中的水和CO2进入干燥管I中影响对CO2的测量(2分)
(5)使装置中的CO2全部到干燥管I中被吸收,减少误差。(2分)?(6)80%(3分)
本题解析:(1)次氯酸钠具有强氧化性,能把CNO—氧化生成氮气和CO2,所以反应式为2CNO—+6ClO—+8H+=2CO2↑+N2↑+Cl2↑+4H2O。
(2)由于需要通过加热的铜丝吸收氯气,所以应该先点燃丁处的酒精灯。
(3)因为生成的气体需要干燥,所以丙装置中应该盛放浓硫酸,干燥CO2气体。
(4)干燥管I是吸收CO2的,因此为了防止空气中的水和CO2进入干燥管I中影响对CO2的测量,需要再连接1个干燥管。
(5)由于装置中会残留部分CO2,所以通入氮气的目的是使装置中的CO2全部到干燥管I中被吸收,减少误差。
(6)干燥管Ⅰ中碱石灰增重1.408g,则反应中生成的CO2是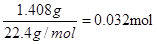 ,所以CNO—的物质的量是0.032mol。CN-的总的物质的量是0.04mol,所以根据原子守恒可知,该实验中测得CN-被处理的百分率为80%。
,所以CNO—的物质的量是0.032mol。CN-的总的物质的量是0.04mol,所以根据原子守恒可知,该实验中测得CN-被处理的百分率为80%。
本题难度:一般