微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 (Ⅰ)原电池是一种将______能转化为电能的装置.如图所示的原电池中,锌片上发生______反应(填“氧化”或“还原”).
(Ⅱ)Li-SOCl2电池可用于心脏起搏器.该电池的电极材料分别为锂和碳,电解液是LiAlCl4-SOCl2.电池的总反应可表示为:4Li+2SOCl2=4LiCl+S+SO2.请回答下列问题:
(1)电池的负极材料是______
(2)电池正极发生的电极反应为______;
(3)组装该电池必须在无水、无氧的条件下进行,原因是______.
(4)SOCl2易挥发,实验室中常用NaOH溶液吸收SOCl2,生成Na2SO3和NaCl.?如果把少量水滴到SOCl2中,实验现象是______,反应的化学方程式为______.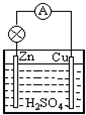
参考答案:(Ⅰ)原电池是把化学能转变成电能的装置;该原电池中锌片作负极,负极上失电子,发生氧化反应.
故答案为:化学;?氧化;
(Ⅱ)(1)锂的活泼性大于碳的,所以锂作负极.
故答案为:锂;
(2)正极上得电子发生还原反应,根据反应方程式知,SOCl2得电子生成Cl-、S、SO2.
故答案为:2SOCl2+4e-=4Cl-+S+SO2
?(3)锂和钠是同一主族的元素,性质具有相似性,钠和空气中的氧气、水蒸气反应,所以锂和空气中的氧气、水蒸气也能反应;SOCl2也可与水反应,所以组装该电池必须在无水、无氧的条件下进行.
故答案为:锂是活泼金属,易与H2O、O2反应;SOCl2也可与水反应.
(4)由NaOH和SOCl2生成Na2SO3和NaCl两种盐知,SOCl2和水生成酸或酸性氧化物,根据原子守恒得,SOCl2和水生成
SO2和HCl,二氧化硫有刺激性气味,HCl遇水蒸气形成小液滴出现白雾,所以实验现象是出现白雾,有刺激性气体生成.
故答案为:出现白雾,有刺激性气体生成;?SOCl2+H2O=SO2↑+2HCl↑.
本题解析:
本题难度:一般
2、选择题 下图为EFC剑桥法用固体二氧化钛(TiO2)生产海绵钛的装置示意图,其原理是在较低的阴极电位下,TiO2(阴极)中的氧解离进入熔盐,阴极最后只剩下纯钛。下列说法中正确的是
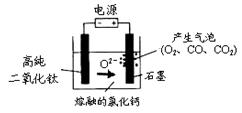
A.阳极的电极反应式为:2Cl-→Cl2↑+2e-
B.阴极的电极反应式为:TiO2 + 4e-→Ti + 2O2-
C.通电后,O2-、Cl-均向阴极移动
D.石墨电极的质量不发生变化
参考答案:B
本题解析:略
本题难度:一般
3、选择题 某燃料电池所用燃料为H2和空气,电解质为熔融的K2CO3。该电池的总反应为2H2+O2 2H2O,负极反应为H2+CO32
参考答案:
本题解析:
本题难度:简单
4、填空题 (6分)铅蓄电池是典型的可充型电池,它的正负极板是惰性材料,电池总反应式为:Pb+PbO2+4H++2SO42- 2PbSO4+2H2O回答下列问题(不考虑氢、氧的氧化还原)
2PbSO4+2H2O回答下列问题(不考虑氢、氧的氧化还原)
(1)放电时:正极的电极反应式是?;当外电路通过1mol电子时,电解液中消耗H2SO4?mol。
(2)充电时,Pb 和电源的?极相连,此时发生的电极反应式为?。
参考答案:(1)PbO2+2e-+4H++SO42-=PbSO4+2H2O? 1
(2)负? PbSO4+2e-=Pb+SO42-
本题解析:(1)放电相当于原电池,在原电池中正极得到电子,根据反应式可知,二氧化铅得到电子,所以正极反应式为PbO2+2e-+4H++SO42-=PbSO4+2H2O。根据总反应式可知,每消耗2mol硫酸,反应中就转移2mol电子,所以如果通过1mol电子,则消耗1mol硫酸。
(2)充电相当于放电的逆反应,放电是铅是负极失去电子,所以充电时铅和电源的负极相连,作阴极,得到电子,所以反应式为PbSO4+2e-=Pb+SO42-。
本题难度:一般
5、填空题 二甲醚(CH3OCH3)被称为21世纪的新型燃料,它清洁、高效,具有优良的环保性能。四川是利用天然气生产二甲醚的重要基地之一。
请填写下列空白:
(1)与二甲醚相对分子质量相等且元素种类相同的有机物的结构简式是:______________________。
(2)二甲醚可由合成气(CO+H2)在一定条件下制得。用合成气制二甲醚时,还产生了一种可参与大气循环的无机化合物,该反应的化学方程式可能是:____________________________________。
(3)以二甲醚、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池。该电池中负极上的电极反应式是:___________________________。
(4)制备二甲醚的合成气可由甲烷与水蒸气或二氧化碳经高温催化反应制得。合成气除制二甲醚外,还可用于冶炼金属,用它冶炼铁的生产过程可示意如下
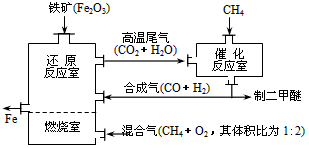
①在催化反应室中进行的反应均为可逆反应,增大体系的压强对甲烷转化率的影响是_________(填“增大”、“减小”或“不变”)。
②在上述炼铁过程的某时间段内,若有x m3(标准状况)的甲烷进入燃烧室中充分燃烧,还原反应室有
5y kg(即×103 mol)铁生成,假设燃烧室与还原反应室产生的高温尾气全部进入催化反应室,则这些高温尾气在理论上可产生合成气_________m3(标准状况)。
参考答案:(1)CH3CH2OH、HCOOH
(2)3CO+3H2 = CH3OCH3+CO2(或2CO+4H2 = CH3OCH3+H2O)
(3)CH3OCH3+16OH--12e- = 2CO32-+11H2O
(4)①减小;②12(x+y)
本题解析:
本题难度:一般