微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 锌铜原电池产生电流时,阴离子
A.移向Zn极,阳离子移向Cu极
B.移向Cu极,阳离子移向Zn极
C.和阳离子都移向Zn极
D.和阳离子都移向Cu极
参考答案:A
本题解析:
本题难度:困难
2、选择题 把a、b、c三块金属片浸入稀硫酸中,用导线两两相连组成原电池。若a、b相连时,a为负极;b、c相连时,电子由c经导线流向b ;a、c相连时,c极上产生大量气泡,则三种金属的活动性由强到弱的顺序为
A.a > b > c
B.a > c > b
C.c > a > b
D.c > b > a
参考答案:B
本题解析:试题分析:原电池中较活泼的金属是负极,失去电子,发生氧化反应。电子经导线传递到正极,所以溶液中的阳离子向正极移动,正极得到电子,发生还原反应。若a、b相连时,a为负极,说明a的金属性强于b的;b、c相连时,电子由c经导线流向b,说明c的金属性强于b的;a、c相连时,c极上产生大量气泡,说明c是正极,金属性是a强于c,则金属性强弱顺序是a > c > b,答案选B。
考点:考查根据原电池进行金属性强弱的判断
点评:该题是高考中的常见题型,属于中等难度试题的考查。试题难易适中,基础性强,侧重考查学生灵活运用原电池原理解决实际问题的能力,有利于提高学生的逻辑推理能力和学习效率。该题的关键是明确原电池的工作原理,然后结合题意灵活运用即可。
本题难度:困难
3、选择题 下列叙述正确的是
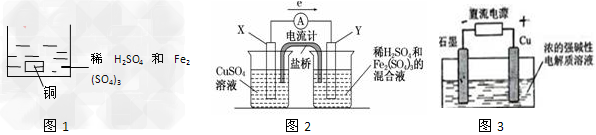
[? ]
A.如图1所示将一定量的铜片加入到100?mL稀硫酸和硫酸铁的混合溶液中,若铜片完全溶解时(不考虑盐的水解及溶液体积的变化),溶液中的Fe3+、Cu2+、H+三种离子的物质的量浓度相等,且测得溶液的pH=1,则溶液中c(SO42-)为0.5mol/L
B.如图2所示的装置中发生Cu+2Fe3+===Cu2++2Fe2+的反应,X极是负极,Y极的材料名称可以是铜
C.Cu2O是一种半导体材料,基于绿色化学理念设计的制取.Cu2O的电解池示意图如图3所示,石墨电极上产生氢气,铜电极发生还原反应
D.?如图3所示当有0.1mol电子转移时,有0.1molCu2O生成
参考答案:A
本题解析:
本题难度:一般
4、选择题 下图各装置中(电解质溶液均为硫酸),不能构成原电池的是
参考答案:D
本题解析:构成原电池的条件是活泼性不同的金属或金属和非金属,两电极导线相连后插入电解质溶液中。在选项D中两电极没有同时插入稀硫酸中,即没有构成完整的闭合回路,因此不能构成原电池。答案选D。
本题难度:简单
5、填空题 新型锂离子电池材料Li2 MSiO4(M为Fe,Co,Mn,Cu等)是一种发展潜力很大的电池电极材料。工业制备Li2 MSiO4有两种方法:
方法一:固相法,2Li2SiO3+ FeSO4 Li2FeSiO4 +Li2SO4 +SiO2
Li2FeSiO4 +Li2SO4 +SiO2
方法二:溶胶—凝胶法,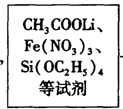
 Li2FeSiO4
Li2FeSiO4
(1)固相法中制备Li2 FeSiO4过程采用惰性气体气氛,其原因是 ;
(2)溶胶—凝胶法中,检查溶液中有胶体生成的方法是 ;生产中生成Imol Li2FeSiO4整个过程转移电子物质的量为 mol;
(3)以Li2 FeSiO4和嵌有Li的石墨为电极材料,含锂的导电固体作电解质,构成电池的总反应式为:Li+ LiFeSiO4 Li2FeSiO4则该电池的负极是____ ;充电时,阳极反应的电极反应式为 ;
Li2FeSiO4则该电池的负极是____ ;充电时,阳极反应的电极反应式为 ;
(4)使用(3)组装的电池必须先____ 。
参考答案:(11分)(1)防止Fe2+被氧化成Fe3+ (2分) ;
(2)用一束强光照射溶液,从侧面能观察到一条光亮的通路。(2分);1mol (2分)
(3)嵌有Li的石墨(2分) Li2FeSiO4-e-=LiFeSiO4+Li+(2分) (4)充电(1分)
本题解析:(1)Fe2+具有还原性,故采用惰性气体气氛的原因是防止Fe2+被氧化成Fe3+。
(2)检查有无胶体生成,利用胶体的特征现象,即用一束强光照射溶液,从侧面能观察到一条光亮的通路。
(3)电池的负极失去电子、化合价升高,故负极是嵌有Li的石墨。阳极失去电子,化合价升高,电极式为Li2FeSiO4-e-=LiFeSiO4+Li+。
(4)使用(3)组装的电池必须先充电。
考点:锂电池的制备原理 信息题
点评:本题考查的是锂电池的制备原理的信息题,题目难度大,利用好题中信息是解题的关键。
本题难度:困难