微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下表是元素周期表主族元素的一部分。
短周期元素X的最高正价是+5价,Y单质可在空气中燃烧。下列说法正确的是
A.Z的元素符号是S, 原子结构示意图为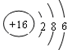
B.W、X、Y、Z的气态氢化物的稳定性依次减弱
C.W、X、Y的最高价氧化物对应水化物的酸性依次增强
D.Y有两种常见的同素异形体,化学式分别为Y2与Y3
参考答案:C
本题解析:依短周期元素X的最高正价是+5价,知X为第五主族元素,则W为第四主族元素,而Y Z为第六主族元素;又据Y单质可在空气中燃烧,知Y不是氧而是硫,故知Z是硒,X是磷,W是硅,所以答案A错误。
B 错误 据元素周期律,W`X Y属同周期元素其非金属性依次增强,相应气态氢化物稳定性也逐渐增强,Y Z属同主族元素,其非金属性逐渐减弱,相应气态氢化物稳定性也逐渐减弱
C 正确 元素周期律知W、X、Y的非金属性逐渐增强,所以其最高价氧化物对应水化物的酸性也依次增强
D 错误 硫的同素异形体不同于氧
本题难度:一般
2、选择题 下列各选项所述的两个量,前者一定大于后者的是
①Al原子和N原子的未成对电子数?②Ag+、Cu2+与NH3形成配合物时的配位数
③NaCl的晶格能与MgO的晶格能?④F元素和O元素的电负性
⑤N元素和O元素的第一电离能?⑥H原子和H+离子的半径
A.①④⑤
B.②④⑥
C.④⑤⑥
D.③⑤⑥
参考答案:C
本题解析:①Al只有1个未成对电子,N有3个未成对电子;
②Ag为2;Cu为4;
③半径越小,电荷越多,晶格能越高;
④非金属性越强,电负性越大;
⑤N,2P3,半充满,第一电离能大于O;
⑥H原子比离子多一个电子层;故半径大。
本题难度:一般
3、填空题 (10分)有A、B、C、D四种短周期元素,它们的核电荷数依次增大,A与C、B与D分别是同主族元素,B、D两元素的质子数之和是A、C两元素质子数之和的两倍,这四种元素中有一种元素的单质易溶于CS2中。
试回答下列问题:
(1)B的名称是________,画出它的简单离子的结构示意图________.
(2)由A、B、C所形成化合物的电子式为________它是由________键和________键组成的________化合物.
(3)由A、B、C、D四种元素组成的化合物的化学式为________、________;写出这两种物质间相互反应的离子方程式________.
参考答案:(10分)(1)氧元素?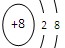 ?(2 )
?(2 )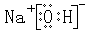 ?离子、共价、离子
?离子、共价、离子
(3) NaHSO4、NaHSO3? H++HSO3- = SO2↑+H2O
本题解析:由题意知在周期表中A与C:A在上C在下,B与D:B在上D在下,B、D两元素的质子数
之和是A、C两元素质子数之和的两倍,推测A、B、C、D分别是H、O、Na、S,
⑴B是氧元素,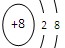
⑵A、B、C所形成化合物为氢氧化钠,电子式为: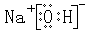 含离子、共价键;
含离子、共价键;
⑶由A、B、C、D四种元素组成的化合物的化学式为 NaHSO4、NaHSO3。
本题难度:一般
4、填空题 (1)原子核内无中子的元素可放在元素周期表的?族,又根据最高正化合价和负化合价的绝对值相等可放在?族,该元素还可放在元素周期表的?族。它的核外电子排布式为?,它和氧元素可形成的化合物的电子式为?。
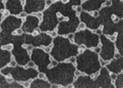
(2)科学家发现在特殊条件下,水能表现出许多有趣的结构和性质。一定条件下给水施加一个弱电场,常温常压下水结成冰,俗称“热冰”。
 ?
? ?
?
A? B
则A、B两幅图中能表示“热冰”的示意图为?。使水结成“热冰”采用“弱电场”的条件,说明水分子是?分子。(选填“极性”或“非极性”)
(3)用高能射线照射液态水时,一个水分子能释放出一个电子,同时产生一种阳离子(H2O+)。这种阳离子具有较强的氧化性,试写出该离子与H2S的水溶液反应的离子方程式?;该反应破坏的化学键是?。
参考答案:

本题解析:略
本题难度:一般
5、填空题 短周期主族元素X、Y、Z、W、M、N 的原子序数依次增大,且原子最外层电子数之和为23。X 的原子半径比Y 的小,X 与W 同主族,Z 的最外层电子数是电子层数的3倍,M 是地壳中含量最高的金属元素。
(1)M的离子结构示意图____________,X、Y形成的含18电子的化合物的电子式____________
用电子式表示由W、Z形成的只含离子键的化合物的形成过程______________________
(2)Y、Z、M原子半径由大到小的顺序____________(用元素符号表示),Z的氢化物稳定性_____N的氢化物稳定性(填“>” “<”或 “=”)
(3)X和Z组成的化合物中,既含有极性共价键又含有非极性共价键的是_________(填化学式),此化合物可将碱性工业废水中的CN-氧化为碳酸盐和氨气,相应的离子方程式为:___________________________________________________________。
(4)由以上元素中两种或多种组成的化合物A、B、C、D有下列转化关系:
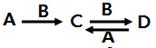
已知A溶液显碱性,可促进水的电离,用离子方程式表示A溶液显碱性的原因___________________,写出A与D反应的离子方程式______________________________。
参考答案:(1) (1分)?
(1分)?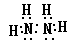 ?(1分)
?(1分)
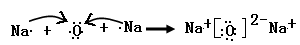 ? (2分)
? (2分)
(2)Al>N>O? (2分)? > (1分)
(3)H2O2? (1分)?H2O2+CN-+OH-=CO32-+NH3 ↑? (2分)
(4) AlO2- +2H2O Al(OH)3 +OH- (2分)? Al3 ++3AlO2- +6H2O?="4" Al(OH)3↓(2分)
Al(OH)3 +OH- (2分)? Al3 ++3AlO2- +6H2O?="4" Al(OH)3↓(2分)
本题解析:短周期元素为从氢到氩,地壳中含量最高的金属元素为Al,故M为Al ;Z 的最外层电子数是电子层数的3倍,得知Z的电子层数为2,最外层电子数为6,故Z为O;X 的原子半径比Y 的小,说明X为H,X 与W 同主族,W的原子序数介于Z和M之间,得知W为Na, 原子最外层电子数之和为23,得知Y和N的最外层电子数之和为12,Y的最外层电子数只能小于6,故N为Cl,Y为N。
(1)X、Y分别为N、H,能形成的18电子化合物只可能是N2H4
(2)根据元素周期律,同周期元素半径逐渐减小,同主族元素半径逐渐增大,判断Al>N>O;O的非金属性大于Cl的非金属性,其氢化物稳定性大于Cl的氢化物稳定性。
(3)H和O既能形成共价键又能形成离子键的化合物只能是H2O2
(4)此题考查AlO2-、 Al(OH)3、 Al3 +三者相互转化的关系
本题难度:一般