| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学必备知识点《物质的量》考点预测(2017年强化版)(二)
参考答案:B 本题解析:①标准状况下水不是气态,不能适用于气体摩尔体积,则lL HCl和lL H2O的物质的量不相同,错误;②标准状况下,lg H2和14g N2的物质的量均是0.5mol,体积相同,正确;③28gCO的物质的量是1mol,其体积不一定为22.4L,错误;④两种物质的物质的量相同,则它们在标准状况下的体积不一定也相同,因为不一定都是气体,错误;⑤根据PV=nRT可知在同温同体积时,气体的物质的量越大,则压强越大,正确;⑥同温同压下,气体的密度与气体的相对分子质量成正比,正确,答案选B。 本题难度:一般 2、选择题 当O2和O3的物质的量比之为3∶2时,它们具有相同的。 参考答案:A 本题解析:n(O2):n(O3)= 3∶2则他们的氧原子数目之比为:3×2:2×3=1:1即分子数相等。故正确选项为D。 本题难度:简单 3、选择题 同质量的SO2与SO3含氧原子数目之比为( ) 参考答案:D 本题解析: 本题难度:一般 4、选择题 用向上排空气法在容积为V mL的集气瓶中收集HCl,收集后瓶内气体的密度是相同条件下He密度的8.75倍。将此集气瓶倒置于水中,瓶内水面上升到一定高度后立即停止上升,则同温同压下,瓶内剩余气体的体积为(? ) 参考答案:B 本题解析:由已知得瓶内气体的 本题难度:简单 5、实验题 (14分)实验室可以用高锰酸钾和浓盐酸反应制取氯气,反应的化学方程式如下: |
参考答案:
(1)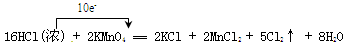 (2)1:5 (3)强(4)22.4
(2)1:5 (3)强(4)22.4
(5)①胶头滴管 100mL容量瓶 (1+1分)②7.9g ③CD (其余每空2分,共14分)
本题解析:(1)用单线桥法标出电子转移的方向和数目是要注意电子从还原剂指向氧化剂,线桥只标明电子的个数不注明反应原子的个数。(2)该反应中盐酸既是还原剂还起到酸的作用,从化合价变化来看,只有10个氯原子的化合价改变了,所以10分子HCl做还原剂,则氧化剂与还原剂物质的量之比是1:5。(3)根据氧化还原反应中氧化剂的氧化性要强于氧化产物的氧化性,所以KMnO4的氧化性比Cl2的氧化性要强。(4)设生成氯气的物质的量为n,则:
2KMnO4 +16HCl(浓) 2KCl + 2MnCl2 + 5Cl2↑ +8H2O 10e-
5 10
n 2 n=1mol V(Cl2)=1mol×22.4L/mol=22.4L(5)①溶液配制是还要用到胶头滴管和容量瓶,容量瓶注意要到规格,②KMnO4固体质量:m="n×M=c×v×M=0.5" mol.L-1×0.1 L×158g/mol=7.9g③俯视会导致溶液的体积变小,浓度就变大;在定容的时候要加水,所以容量瓶内壁附有水珠对浓度没有影响;颠倒摇匀溶液体积发生变化是由于分子间作用力造成的,再加水会使得溶液体积增大,浓度变小;溶解过程中有少量液体溅出烧杯外会造成溶质有损失,浓度变小,选CD。
考点:氧化还原反应的概念和电子的转移计算、一定物质的量浓度溶液的配制。
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学知识点归纳《电解质溶液.. | |