微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (10分) 某同学用如图所示装置探究SO2的性质及其有关实验.

(1)实验室用亚硫酸钠固体和一定浓度的硫酸反应制备SO2气体,写出该反应的化学方程式______________________________________________________________
(2)分别将SO2气体通入下列C溶液中,请回答下列问题:
①少量SO2通入紫色石蕊试液,现象是______________,继续通入过量SO2气体,现象是________________.
②SO2通入紫色KMnO4溶液,现象是______________,其反应的离子方程式为_______________________.
③过量SO2慢慢地通入澄清石灰水中,现象___________________________________
④若C为双氧水,则通入SO2后,请大胆判断所得溶液是________(填溶质的化学式),若该同学制备的SO2气体中混有CO2气体,产生杂质的原因可能是亚硫酸钠固体中混有__________.
参考答案:(1)Na2SO3+H2SO4===Na2SO4+SO2↑+H2O
(2)①变红(1分) 不褪色或不明显
②颜色逐渐变淡或紫色消失? 5SO2+2MnO+2H2O===5SO+2Mn2++4H+
③先变浑浊,后又变澄清
④H2SO4? 碳酸盐或碳酸氢盐
本题解析:(1)实验室制备SO2的方程式为:Na2SO3+H2SO4===Na2SO4+SO2↑+H2O
(2)①SO2虽然有漂白性,但是不能漂白石蕊,只能使石蕊变红不能褪色。
②SO2具有强还原性所以通入到KMnO4溶液中,KMnO4溶液紫色褪去。反应的离子方程式为:5SO2+2MnO+2H2O===5SO+2Mn2++4H+。
③CaSO3难溶Ca(HSO3)2可溶,所以SO2通入澄清石灰水中产生沉淀,继续通入,沉淀溶解。
④H2O2具有氧化性,SO2具有还原性,所以将SO2通入到H2O2中能反应生成H2SO4。如果制得的SO2混有CO2杂质,说明Na2SO3中混有了Na2CO3或NaHCO3。2的性质
点评:本题非常基础,主要考查学生对SO2性质的掌握。
本题难度:一般
2、填空题 从某物质A的水溶液出发有下图所示的一系列变化:?
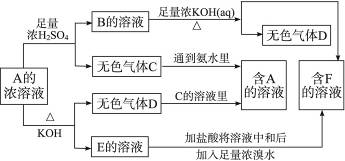
试完成下列问题:?
(1)物质的化学式:A____________,B____________,C____________,D____________,E____________,F____________。?
(2)写出EF的离子方程式________________________。?
(3)鉴定物质F的方法________________________。?
参考答案:(1)(NH4)2SO3(或NH4HSO3) (NH4)2SO4或(NH4HSO4) SO2 NH3? K2SO3? K2SO4
(2) +H2O+Br2====
+H2O+Br2==== +2H++2Br-
+2H++2Br-
(3)取少量含F的溶液于试管中,滴入稀HCl(aq),若无现象,然后滴入BaCl2(aq)?有白色沉淀生成,则证明F溶液中含 。进行焰色反应,若溶液焰色为紫色,则证明F溶液中含K+。
。进行焰色反应,若溶液焰色为紫色,则证明F溶液中含K+。
本题解析:A与浓H2SO4反应生成无色气体C,A中酸根应为易挥发的弱酸的酸根;C通到氨水里又生成A,证明A中阳离子为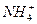 ,则D为NH3,E当为弱酸的钾盐,它能被溴水氧化,当为K2SO3。其余易推出。
,则D为NH3,E当为弱酸的钾盐,它能被溴水氧化,当为K2SO3。其余易推出。
SO2对CO2的检验形成干扰,所以须事先除去SO2,还要检验是否除净,然后才能验证CO2的存在。SO2具有一定的还原性,可用卤水(溴水、碘水、氯水)或KMnO4(H+,aq)将其除去。SO2是酸性氧化物,可用碱液将其除去。
本题难度:简单
3、实验题 某化学小组进行Na2SO3的性质实验探究。
(1)在白色点滴板的a、b、c三个凹槽中滴有Na2SO3溶液,再分别滴加下图所示的试剂:
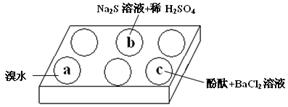
实验现象如下表:
编号
| 实验现象
|
a
| 溴水褪色
|
b
| 产生淡黄色沉淀
|
c
| 滴入酚酞溶液变红,再加入BaCl2溶液后产生沉淀且红色褪去
|
?
根据实验现象进行分析:
① a中实验现象证明Na2SO3具有?性。
② b中发生反应的离子方程式是?。
③ 应用化学平衡原理解释c中现象(用化学用语及简单文字表述)?。
(2)在用NaOH 溶液吸收SO2的过程中,往往得到Na2SO3和NaHSO3的混合溶液,溶液pH 随n(SO32-):n(HSO3-) 变化关系如下表:
? n(SO32—): n(HSO3—)
| 91:9
| 1:1
| 9:91
|
pH
| 8.2
| 7.2
| 6.2
|
?
① 当吸收液中n(SO32-):n(HSO3-) ="10:1" 时,溶液中离子浓度关系正确的是?(填字母)。
A.c(Na+) +c(H+) = 2c(SO32-) +c(HSO3-) + c(OH-)
B.c(Na+) > c(HSO3-) >? c(SO32-) > c(OH-)>c(H+)
C.c(Na+) > c(SO32-)? > c(HSO3-) > c(OH-)>c(H+)
②若n(SO32-):n(HSO3-) = 3:2,则0.8 mol NaOH溶液吸收了标准状况下的SO2 ??L。
参考答案:(10分)
(1)①还原性?(2分)
②SO32-+2S2-+6H+=" 3S↓+3" H2O (2分)
③在Na2SO3溶液中,SO32-水解显碱性:SO32-+H2O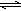 HSO3-+OH-,所以滴入酚酞后溶液变红;在该溶液中加入BaCl2后,Ba2++SO32-=BaSO3↓(白色),由于c(SO32-)减小,SO32-水解平衡左移,c(OH-)减小,红色褪去。(2分)
HSO3-+OH-,所以滴入酚酞后溶液变红;在该溶液中加入BaCl2后,Ba2++SO32-=BaSO3↓(白色),由于c(SO32-)减小,SO32-水解平衡左移,c(OH-)减小,红色褪去。(2分)
(2)①AC?(2分)
②11.2?(2分)
本题解析:(1)①SO2+Br2+2H2O=H2SO4+2HBr,SO2中S化合价升高,被氧化,显还原性,答案:还原性?(2分)
②酸性条件下,+4价的S和-2价的S反应,生成0价的S,故有淡黄色沉淀,答案:SO32-+2S2-+6H+=" 3S↓+3" H2O (2分)
③SO32―是弱酸根离子,水解后呈碱性,加Ba2+水解平衡被破坏;答案:在Na2SO3溶液中,SO32-水解显碱性:SO32-+H2O HSO3-+OH-,所以滴入酚酞后溶液变红;在该溶液中加入BaCl2后,Ba2++SO32-=BaSO3↓(白色),由于c(SO32-)减小,SO32-水解平衡左移,c(OH-)减小,红色褪去。(2分)
HSO3-+OH-,所以滴入酚酞后溶液变红;在该溶液中加入BaCl2后,Ba2++SO32-=BaSO3↓(白色),由于c(SO32-)减小,SO32-水解平衡左移,c(OH-)减小,红色褪去。(2分)
(2)①A正确,溶液中存在电荷守恒,B不正确,c(SO32-) > c(HSO3-),C、正确,n(SO32—): n(HSO3—)= 91:9时,pH=8.2,溶液呈碱性,c(Na+) > c(SO32-)? > c(HSO3-) > c(OH-)>c(H+),正确。故答案:AC?(2分)
②若n(SO32-):n(HSO3-) = 3:2,则0.8 mol NaOH溶液吸收了标准状况下的SO2的体积,令n(SO32-)=3x,则由Na+ 守恒得:3x×2+2x=0.8mol,x=0.1mol,n(SO2)=0.5mol,v(SO2?)=0.5mol×22.4l·mol-1=11.2L,答案:11.2?(2分)
本题难度:困难
4、实验题 Ⅰ.实验室可用铜和浓硫酸加热或硫酸和亚硫酸钠反应制取二氧化硫。如果用硫酸和亚硫酸钠反应制取二氧化硫,并希望能控制反应速度,下图中可选用的发生装置是 ??(填写字母)。
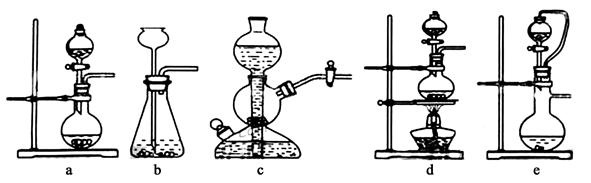
Ⅱ.A图表示某学生对SO2与漂粉精[80%Ca(ClO)2)]的反应进行实验探究的过程,观察到的现象有:
①.液面上方出现白雾;
②稍后,出现浑浊,溶液变为黄绿色;
③稍后,产生大量白色沉淀,黄绿色褪去
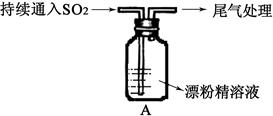
(1)向水中持续通入SO2,未观察到白雾。推测现象①中的白雾由HCl小液滴形成,进行如下实验:
a.用湿润的碘化钾淀粉试纸检验白雾,无变化;
b.用酸化的AgNO3溶液检验白雾,产生白色沉淀。
由实验a、b不能判断白雾中含有HCl,理由是?。
(2)③中大量白色沉淀的成份是?。
(3)现象②中溶液变为黄绿色的可能原因:随溶液酸性的增强,漂粉精的有效成分和C1-发生反应产生了Cl2。通过进一步实验确认了这种可能性,其实验方案是??。
(4)用离子方程式解释现象③中黄绿色褪去的原因:?。
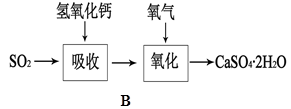
(5)B图表示石灰-石膏法吸收SO2的工艺流程,写出反应的化学方程式。
?。
参考答案:Ⅰ.ae (2分)
Ⅱ.⑴ 白雾中含有SO2也能与酸化的AgNO3反应生成白色沉淀(2分)
⑵CaSO4 (2分)
⑶可取适量原溶液加入一定量的稀硫酸观察到溶液变黄绿色(2分)
⑷ Cl2+SO2+2H2O=4H++2Cl-+SO42-? (2分)
⑸ SO2+Ca(OH)2=CaSO3↓+H2O ,2CaSO3+O2+4H2O=2{CaSO4·2H2O。}(2分)
本题解析:Ⅰ.用硫酸和亚硫酸钠反应制取二氧化硫,并希望能控制反应速度,由于反应不需要加热,排除装置d;由于亚硫酸钠是细小颗粒,不可选用装置bc。故可选用的发生装置是ae。Ⅱ若白雾中含有SO2,也能与酸化的AgNO3反应生成白色硫酸银沉淀。SO2,也被氧化为硫酸,硫酸和次氯酸钙发生复分解反应生成磷酸钙白色沉淀。可取适量原溶液加入一定量的稀硫酸,Cl-、ClO-、H+发生归中反应得到黄绿色氯气,而使溶液变黄绿色。有氧化性Cl2和还原性的有SO2在水溶液中发生氧化还原反应生成硫酸和盐酸,从而失去氯气的黄绿色。Cl2+SO2+2H2O=4H++2Cl-+SO42-。石灰-石膏法吸收SO2的的化学方程式SO2+Ca(OH)2=CaSO3↓+H2O ,2CaSO3+O2+4H2O=2{CaSO4·2H2O}。2危害,变废为宝。
本题难度:一般
5、选择题 将等体积的SO2和Cl2充分混合,通入加有品红的氯化钡溶液,可观察到的现象是(? )
A.溶液快速褪色
B.溶液缓慢褪色
C.生成白色沉淀
D.生成浅黄色沉淀
参考答案:C
本题解析:
正确答案:C
Cl2+SO2+2H2O=H2SO4+2HCl,失去漂白性,生成的H2SO4与BaCl2生成沉淀。
本题难度:简单