微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 某品牌消毒液包装说明的部分内容摘录如下:主要有效成份为次氯酸钠,有效氯含量8000-10000mg/L。可用于各类家居用品、餐具、棉织衣物等的消毒,对彩色织物可能有褪色作用。切勿用于丝绸、毛、尼龙、皮革、油漆表面,勿用于铝、铜、碳钢制品。本品须密封,置阴凉暗处保存。请完成以下实验探究过程:
1.阅读材料,获取信息
⑴推测该消毒液的酸碱性:?,原因是(用离子方程式表示)?。
⑵该消毒液还具有的化学性质是?性和?性。
⑶从该消毒液的保存要求分析,导致其失效的外界因素主要是?。
2.确定要研究的问题
该消毒液对碳钢制品是否有腐蚀作用?
3.设计方案,实施探究
用烧杯取少量样品,将一颗光亮的铁钉放入烧杯,浸泡一段时间。对可能产生的现象有如下假设:
假设①:有明显现象;假设②:无明显现象。
⑷基于假设①,结论是铁钉被腐蚀,预期的实验现象是?。
⑸基于假设②,结论是?,请设计实验进一步验证该结论,叙述实验操作:?。
参考答案: ⑴碱性(2分)? ClO- +H2O?HClO+OH-(2分)
⑴碱性(2分)? ClO- +H2O?HClO+OH-(2分)
⑵氧化性,漂白性,不稳定性(任写两个,每空2分)
⑶CO2等酸性气体、光和热?(2分)
⑷铁钉表面出现铁锈(或红褐色固体)(2分)
⑸铁钉可能未被腐蚀,也可能被腐蚀但无明显现象(2分)
用试管取出少量浸泡后的溶液,滴加足量的稀硫酸酸化,再滴加几滴KSCN溶液。(2分)
本题解析:1.⑴次氯酸钠为强碱弱酸盐,水解显碱性。⑵因为是用来消毒的,所以应具有氧化性,由“可用于各类家居用品、餐具、棉织衣物等的消毒,对彩色织物可能有褪色作用。切勿用于丝绸、毛、尼龙、皮革、油漆表面,勿用于铝、铜、碳钢制品。”可推知具有漂白性,由“本品须密封,置阴凉暗处保存。”可推知具有不稳定性。⑶次氯酸钠可与二氧化碳、水反应生成次氯酸,次氯酸不稳定,光照易分解。
3.⑷铁钉被腐蚀,就是发生了化学反应,使铁钉表面出现铁锈。⑸此问考查的使三价铁离子的验证方法,验证三价铁离子,使用KSCN溶液效果最好。
本题难度:一般
2、选择题 下列说法不正确的是
[? ]
A.假说经过反复验证和修正,才发展成为科学的理论
B.模型一般可分为物体模型和思维模型
C.研究物质的性质常用观察、实验、分类、比较等方法
D.科学实验能解决化学学科的所有问题
参考答案:D
本题解析:
本题难度:简单
3、实验题 下图中的实验装置可以用于实验室制取乙炔。请填空:
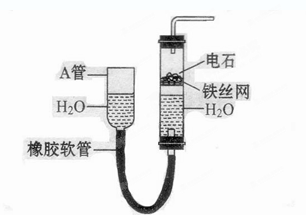
(1) 图中A管的作用是?,
制取乙炔的化学反应方程式为?。
(2)乙炔通入酸性KMnO4溶液中,发生?反应,可以观察到?
现象,若通入溴水中,发生?反应。
(3)乙炔燃烧的化学方程式为?,燃烧时的现象为?,
为了安全,点燃乙炔前应该先?。
参考答案:(1)调节水面的高度来控制反应的发生和停止
CaC2+H2O Ca(OH)2+
Ca(OH)2+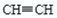 ↑(2)氧化?紫色酸性高锰酸钾溶液逐渐褪色?加成
↑(2)氧化?紫色酸性高锰酸钾溶液逐渐褪色?加成
(3)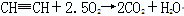 ?明亮火焰?黑色浓烟?验纯
?明亮火焰?黑色浓烟?验纯
本题解析:(1) 图中A管是可以上下移动的,所以可以通过调节水面的高度来控制反应的发生和停止。实验室制取乙炔的化学方程式是CaC2+H2O Ca(OH)2+
Ca(OH)2+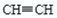 ↑。
↑。
(2)乙炔含有碳碳三键,能被酸性高锰酸钾溶液氧化,也能和溴水发生加成反应,所以乙炔通入酸性KMnO4溶液中,发生氧化反应,可以观察到紫色酸性高锰酸钾溶液逐渐褪色;若通入溴水中,发生加成反应。
(3)乙炔是可燃性气体,点燃前相应检验乙炔的纯度。由于乙炔中含碳量高,所以燃烧时有黑色浓烟生成,反应的化学方程式是2HCH2+5O2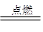 4CO2+2H2O。
4CO2+2H2O。
点评:该题是基础性试题的考查,难度不大。试题贴近教材,基础性强,旨在巩固学生的基础,提高学生的应试能力。明确乙炔的实验室制备原理、乙炔的结构特点和性质特点,是答题的关键。
本题难度:一般
4、简答题 某小组为证明同温同压下,同浓度,同体积的酸性不同的两种二元酸与足量镁带反应时生成H2量相同而反应速率不同,装置如图.主要步骤如下:
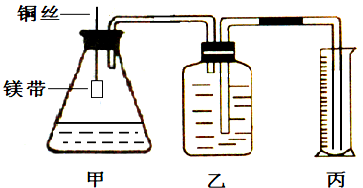
(1)配制浓度为0.5mol/L的硫酸和草酸溶液;
(2)用______量取10.00mL0.5mol/L的硫酸和草酸溶液分别加入两锥形瓶中;
(3)分别取去表面氧化膜的鎂带系于铜丝末端;
(4)检查装置气密性,乙中装满水,按图连接好装置;
(5)将铜丝下移,使足量鎂带浸如酸中(铜丝不与酸接触)至完全反应,同时记录______;
(6)反应结束时,读取量筒内水体积ymL.
将以上步骤补充完整并回答下列问题
(1)(4)中如何检查气密性______;
(2)用ρ=1.84?98.3%的浓硫酸配制250mL,c=0.5mol/L硫酸,主要仪器有______、______、烧杯、玻璃棒、酸式滴定管等;
(3)读取量筒内水体积时,必须注意的问题是______;
(4)简述速率不等的原因______,铜丝不能与酸接触的原因______;
(5)此实验说明草酸为弱酸,请再设计一实验证明:______.
参考答案:酸溶液应用酸式滴定管量取,如用碱式滴定管会腐蚀橡胶管;比较化学反应速率,必须是比较一定时间之内的反应物浓度的变化或其它量的变化,故答案为:酸式滴定管;反应所需时间;
(1)如不漏气,加热时容器内压强增大,会有气泡冒出,故答案为:往丙中加水没过导气管口下端,两手掌紧贴甲外壁一会儿,若观察到丙中导气管冒气泡,表明装置不漏气;
(2)配制溶液所需仪器有:250ml容量瓶、烧杯、玻璃棒、量筒或滴定管、胶头滴管等.故答案为:250ml容量瓶、胶头滴管;
(3)读数时要保持左右气体压强相等,以减少误差,故答案为:读数时保持乙丙中液面相平;待装置冷却至室温再读数;
(4)影响化学反应速率的因素有浓度、温度、压强等,本题为浓度不同,为测定镁与酸反应的速率,不能将铜丝与酸接触,否则易形成原电池,加快反应速率,干扰实验测定,
故答案为:H+浓度不同;与铜易形成原电池,加快反应速率,干扰实验测定;
(5)弱电解质存在电离平衡、不完全电离等性质,可任意选择合理方法,故答案为:测定草酸钠溶液的PH,如大于7,则为弱酸(其它合理答案也可以).
本题解析:
本题难度:一般
5、实验题 (13分)某研究性学习小组在网上收集到如下信息: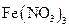 溶液可以蚀刻银,制作美丽的银饰。他们对蚀刻银的原因进行了如下探究:
溶液可以蚀刻银,制作美丽的银饰。他们对蚀刻银的原因进行了如下探究:
【实验】制作银镜,并与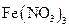 溶液反应,发现银镜溶解。
溶液反应,发现银镜溶解。
(1)下列有关制备银镜过程的说法正确的是?。
a. 边振荡盛有2%的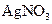 溶液的试管,边滴入2%的氨水,至最初的沉淀恰好溶解为止
溶液的试管,边滴入2%的氨水,至最初的沉淀恰好溶解为止
b.将几滴银氨溶液滴入2ml乙醛中
c.制备银镜时,用酒精灯的外焰给试管底部加热
d.银氨溶液具有较弱的氧化性
e.在银氨溶液配置过程中,溶液的pH增大
【提出假设】
假设1: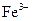 具有氧化性,能氧化Ag。
具有氧化性,能氧化Ag。
假设2: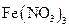 溶液显酸性,在此酸性条件下
溶液显酸性,在此酸性条件下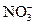 能氧化Ag。
能氧化Ag。
【设计实验方案,验证假设】
(2)甲同学从上述实验的生成物中检验出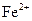 ,验证了假设1的成立。请写出
,验证了假设1的成立。请写出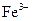 氧化Ag的离子方程式:?。
氧化Ag的离子方程式:?。
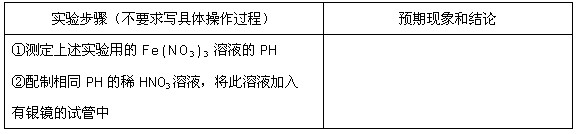
(3)乙同学设计实验验证假设2,请帮他完成下表中内容(提示: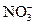 在不同条件下的还原产物较复杂,有时难以观察到气体产生)。
在不同条件下的还原产物较复杂,有时难以观察到气体产生)。
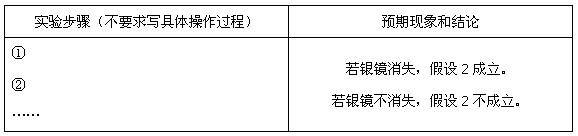
【思考与交流】
(4)甲同学验证了假设1成立,若乙同学验证了假设2也成立,则丙同学由此得出结论: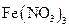 溶液中的
溶液中的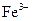 和
和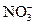 都氧化了Ag。你是否同意丙同学的结论,并简述理由:?。
都氧化了Ag。你是否同意丙同学的结论,并简述理由:?。
参考答案:
(1)a? d? e?
(2)Ag+Fe3+=Ag++Fe2+?
(3)
(4)不同意;甲同学检验出了Fe2+,可确定Fe3+一定氧化了银;乙同学虽然验证了此条件下NO3-能氧化银,但在硝酸铁溶液氧化银时,由于没有检验NO3-的还原产物,因此不能确定NO3-是否氧化了银。
本题解析:略
本题难度:简单