微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 短周期主族元素A、B、C、D、E在元素周期表中的位置如下图所示:
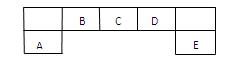
请回答下列问题:
 (1)B、C、D元素电负性的大小顺序为:______>______>______(填元素符号)。
(1)B、C、D元素电负性的大小顺序为:______>______>______(填元素符号)。
 (2)E的氢化物与其最高价氧化物的水化物的钾盐共热能发生反应,生成一种气体单质,反应的化学方程式为_______________________________________________.
(2)E的氢化物与其最高价氧化物的水化物的钾盐共热能发生反应,生成一种气体单质,反应的化学方程式为_______________________________________________.
 (3)C有多种氧化物,其中甲的相对分子质量最小。在一定条件下,2L甲气体与0.5L氧气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成的含氧酸盐的化学式是__________.
(3)C有多种氧化物,其中甲的相对分子质量最小。在一定条件下,2L甲气体与0.5L氧气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成的含氧酸盐的化学式是__________.
 (4)在298K下,A、B的单质各1mol完全燃烧,分别放出热量a kJ和b kJ。又知一定条件下,A的单质能将B从它的最高价氧化物中置换出来,若此置换反应生成3molB的单质,则该反应在298K下的
(4)在298K下,A、B的单质各1mol完全燃烧,分别放出热量a kJ和b kJ。又知一定条件下,A的单质能将B从它的最高价氧化物中置换出来,若此置换反应生成3molB的单质,则该反应在298K下的 =?(注:题中所设单质均为最稳定单质)
=?(注:题中所设单质均为最稳定单质)
 (5)要证明与D同主族相邻元素F的非金属性与E的非金属性的强弱,正确、合理的实验操作及现象是?
(5)要证明与D同主族相邻元素F的非金属性与E的非金属性的强弱,正确、合理的实验操作及现象是?
(6)用A、B的单质作电极,C的最高价氧化物的水化物稀溶液作电解质溶液构成原电池,写出此原电池正极的电极反应式?。(假设C只被还原至+2价)
参考答案: (1)O>N>C(2分)
(1)O>N>C(2分)
 (2)8HCl+KClO4
(2)8HCl+KClO4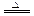 KCl+4Cl2↑+ 4H2O(3分)
KCl+4Cl2↑+ 4H2O(3分)
(3) NaNO2(2分)
 (4)
(4) ?-(4a–3b)KJ/mol或(3b–4a)KJ/mol(3分)
?-(4a–3b)KJ/mol或(3b–4a)KJ/mol(3分)
 (5) 将氯水(或氯气)滴入(通入)到硫化钠(或硫化氢等)溶液中,有淡黄色沉淀生成。(其他合理答案亦可)(2分)
(5) 将氯水(或氯气)滴入(通入)到硫化钠(或硫化氢等)溶液中,有淡黄色沉淀生成。(其他合理答案亦可)(2分)
(6)NO3-+3e-+4H+=NO↑+2H2O(2分)
本题解析:A、B、C、D、E五种元素分别是Al、C、N、O、Cl, (1)
(1) 电负性O>N>C;(2)
电负性O>N>C;(2)
 生成的气体单质是Cl2,反应的化学方程式为:8HCl+KClO4
生成的气体单质是Cl2,反应的化学方程式为:8HCl+KClO4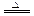 KCl+4Cl2↑+ 4H2O;(3)
KCl+4Cl2↑+ 4H2O;(3) 氮的氧化物中,NO相对分子质量最小,2L NO与0.5LO2混合后先生成1L NO与1L NO2的混合气体,再与NaOH溶液发生下列反应:NO+NO2+2NaOH =2NaNO2+H2O,所以生成的盐是NaNO2;(也可用电子守恒法推出N在盐中显+3价,所以是NaNO2。)(4)
氮的氧化物中,NO相对分子质量最小,2L NO与0.5LO2混合后先生成1L NO与1L NO2的混合气体,再与NaOH溶液发生下列反应:NO+NO2+2NaOH =2NaNO2+H2O,所以生成的盐是NaNO2;(也可用电子守恒法推出N在盐中显+3价,所以是NaNO2。)(4)
 ?在298K下,1molAl(s)完全燃烧放出热量aKJ,1molC(s)完全燃烧放出热量bKJ,根据盖斯定律,可得:-(4a–3b)KJ/mol或(3b–4a)KJ/mol;(5)
?在298K下,1molAl(s)完全燃烧放出热量aKJ,1molC(s)完全燃烧放出热量bKJ,根据盖斯定律,可得:-(4a–3b)KJ/mol或(3b–4a)KJ/mol;(5)
 要证明S的非金属性与Cl的非金属性强弱,可以利用置换反应,将氯水(或氯气)滴入到硫化钠(或硫化氢等)溶液中即可(其他答案:如分别将硫化氢、HCl加热,硫化氢分解生成淡黄色固体而HCl不分解或比较高氯酸与硫酸的酸性,高氯酸的酸性强等较合理答案可给1分)。
要证明S的非金属性与Cl的非金属性强弱,可以利用置换反应,将氯水(或氯气)滴入到硫化钠(或硫化氢等)溶液中即可(其他答案:如分别将硫化氢、HCl加热,硫化氢分解生成淡黄色固体而HCl不分解或比较高氯酸与硫酸的酸性,高氯酸的酸性强等较合理答案可给1分)。
本题难度:一般
2、选择题 已知aA+、bB2+、cC-、dD2-四种离子均具有相同的电子层结构,关于A、B、C、D四种元素的叙述正确的是(?)
A. 原子半径:A>B>C>D? B. 原子序数:b>a>c>d
C. 离子半径:D>C>B>A? D. 失电子能力:B>A,得电子能力:D>C?
参考答案:B
本题解析:依题意知四种元素在周期表的位置为A? B
原子半径:A>B>D>C?原子序数:b>a>c>d
离子半径:D>C>A >B?失电子能力:A>B?得电子能力:C>D
本题难度:一般
3、选择题 关于元素周期表的说法正确的是
A.元素周期表有7个周期
B.元素周期表有8个主族
C.ⅠA族的元素全部是金属元素
D.短周期是指第一、二周期
参考答案:A
本题解析:元素周期表中有7个周期、7个主族;ⅠA族的元素包括氢元素(非金属元素)和碱金属元素;短周期是指第一、二、三周期;综上可知A项正确。
本题难度:简单
4、选择题 下列物质中属于纯净物的是
A.铝热剂
B.铝土矿
C.明矾
D.含镁60%的MgO
参考答案:C
本题解析:明矾是十二水硫酸铝钾,属于纯净物.
本题难度:简单
5、选择题 能够证明电子在原子核外是分层排布的事实是( )
A.电负性
B.电离能
C.第一电离能
D.原子半径
参考答案:B
本题解析:能够证明电子在原子核外是分层排布的事实是电离能,电负性为吸引电子的能力。
本题难度:简单