微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 两种微粒的核外电子数相同,核电荷数不同,则它们可能是?
A.两种不同元素的原子
B.两种不同的离子
C.同一元素的原子和离子
D.两种不同元素的原子和离子
参考答案:BD
本题解析:对于中性微粒,质子数等于核电荷数等于核外电子数,如果核外电子数相同,核电荷数不同,则这两种微粒不可能都是中性微粒,A不正确。同一元素的原子和离子,其核电荷数一定是相同的,C不正确。因此选项BD是正确的,答案选BD。
本题难度:一般
2、填空题 下表是元素周期表一部分,列出了十个元素在周期表中的位置:
?族
周期
| IA
| IIA
| IIIA
| IVA
| VA
| VIA
| VIIA
| 0
|
2
| ?
| ?
| ?
| ⑥
| ⑦
| ?
| ?
| ?
|
3
| ①
| ③
| ⑤
| ?
| ?
| ?
| ⑧
| ⑩
|
4
| ②
| ④
| ?
| ?
| ?
| ?
| ⑨
| ?
|
请用化学用语回答下列问题
(1)在③~⑦元素中,原子半径最大的是? ?(填元素符号);
(2)①~⑩中元素最高价氧化物对应的水化物中酸性最强的是?(填物质化学式),呈两性的氢氧化物是?(填物质化学式);
(3)⑦元素的最高价氧化物对应水化物与其氢化物能生成盐M,M中含有的化学键类型有?;?
(4)用电子式表示元素③与⑧形成化合物的过程?。
(5)写出含有32个电子的元素⑥的氢化物的分子式:?。
(6)写出工业冶炼⑤的化学方程式:?
(7)写出将⑨元素单质从海水中(离子形式存在)提取所涉及到的三个步骤的离子方程式,第一步:Cl2+2Br-=2Cl-+Br2 第二步:??; 第三步Cl2+2Br-=2Cl-+Br2
参考答案:(1)Ca
(2)HClO4、 Al(OH)3?
(3)离子键、(极性)共价键
(4)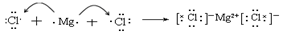
(5)C4H8
(6)2Al2O3 4Al +3O2↑?冰晶石
4Al +3O2↑?冰晶石
(7)Br2+ SO2 +2H2O=4H+ + SO42- + 2Br-
本题解析:①~⑩各元素分别为Na、K、Mg、Ca、Al、C、N、Cl、Br和Ar。(1)电子层数最多的元素,其原子半径最大;(2)元素最高价氧化物对应的水化物酸性最强,则该元素的非金属性最强;(3)M物质为NH4NO3,离子化合物,含有离子键和共价键;(4)元素③与⑧形成化合物氯化镁,离子化合物,故用箭头表示电子的转移;(5)元素⑥的氢化物为CxHy,电子为12x+y=32,x、y之间的关系还应符合烷烃或烯烃或炔烃的通式;(6)Al是活泼金属,工业冶炼需用电解法。
点评:元素周期表及其规律是高考必考知识点,考生在备考中应注意积累掌握短周期元素的结构与性质。
本题难度:一般
3、填空题 (1)R+与S2–所含电子数相同,则R元素的原子序数为?
(2)一种基于酸性燃料电池原理设计的酒精检测仪,正极上的反应为:O2 + 4e– + 4H+ ?= 2H2O,检测有酒精时,电解质溶液中的H+向?极移动,该电池负极上的反应为: ?
(3)X、Y、Z、M、G五种分属三个短周期主族元素,且原子序数依次增大。Z存在质量数为23,中子数为12的核素A;Y、M同主族,可形成MY2、MY3两种分子。
回答下列问题:
①用化学符号表示核素A:?;
②上述元素的最高价氧化物对应的水化物酸性最强的是?(写化学式),写出该物质与氢氧化钠溶液反应的离子方程式:?;
③X2M的电子式为?;
④ZG用途广泛,下列说法正确的是:?。
A.作调味剂
B.用于食物防腐
C.用于氯碱工业
D.用于医疗
参考答案:(1)19?(2)正? CH?3CH2OH – 4e– + H2O = CH3COOH + 4H+
(3) ①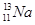 ?② HClO4? OH– + H+ ?= H2O
?② HClO4? OH– + H+ ?= H2O
③ ?④ ABCD
?④ ABCD
本题解析:(1)S2–所含电子数为18,则R所含电子数为18+1=19,故其原子序数为19。
(2)理论上O2可把酒精氧化为CO2,但在酒精检测仪中氧气只能把酒精氧化到乙酸,原电池中阳离子向正极(带负电)移动,故负极的电极反应为:CH?3CH2OH – 4e– + H2O = CH3COOH + 4H+
(3)X、Y、Z、M、G五种分属三个短周期主族元素,且原子序数依次增大,则X为氢元素;Z的核素A质量数为23,中子数为12,则质子数为11,所以M为钠元素;Y、M同主族,可形成MY2、MY3两种分子,则Y、M分别为氧和硫元素,MY2、MY3分别为SO2和SO3,G只能是氯元素。
①核素A的符号为: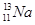 ;②上述五种元素中氯元素的非金属性最强,所以其最高价氧化物的水化物酸性最强,其化学式为:HClO4(高氯酸),高氯酸为强酸,与氢氧化钠溶液反应的离子方程式为:OH– + H+ ?= H2O;③X2M的电子式为H2S,其电子式见答案;④ZG是氯化钠,其用途广泛,可用作调味剂、食物防腐剂、氯碱工业的原料、用于医疗(生理盐水)等。
;②上述五种元素中氯元素的非金属性最强,所以其最高价氧化物的水化物酸性最强,其化学式为:HClO4(高氯酸),高氯酸为强酸,与氢氧化钠溶液反应的离子方程式为:OH– + H+ ?= H2O;③X2M的电子式为H2S,其电子式见答案;④ZG是氯化钠,其用途广泛,可用作调味剂、食物防腐剂、氯碱工业的原料、用于医疗(生理盐水)等。
本题难度:困难
4、选择题 A、B、C三种短周期元素在周期表中的相对位置如图所示,已知A、C分别与B形成化合物X和Y,A与B的质子数之和等于C的质子数,则以下说法判断正确的是(? )
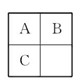
A.B与C均不存在同素异形体
B.X一定是酸性氧化物
C.B的氢化物比A、C的氢化物稳定
D.A与B形成的化合物X有3种
参考答案:C
本题解析:根据A、B、C的位置关系可知,A、B为第二周期元素,C为第三周期元素,设A的原子序数为a,B的原子序数为a+1,C的原子序数为a+8,a+a+1=a+8,a=7。A为N,B为O,C为P。O与P都存在同素异形体,A错;N与O形成的化合物,有的是酸性氧化物如N2O5,有的不是酸性氧化物如NO2、NO等,B错;O的非金属性比N、P强,所以H2O的稳定性比NH3和PH3强,C对;N与O可形成N2O、NO、NO2、N2O3、N2O4、N2O5等多种化合物,D错
本题难度:一般
5、选择题 一种微粒的质子数和电子数与另一种微粒的质子数和电子数均分别相等,则下列两种微粒之间的关系说法错误的是?(?)
A.它们可能是不同的原子
B.可能是不同分子
C.可能是不同的离子
D.可能是一种分子和一种离子
参考答案:D
本题解析:A正确,如碳-12原子与碳-13原子,质子数均为6而电子数也为6的不同原子;B正确,如水分子与HF分子,质子数均为10,电子数也均为10;C正确,如钠离子与铵离子,质子数均为11,电子数均为10;D错,不可能是一种分子和一种离子
本题难度:简单