微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列离子方程式书写正确的是( )
A.将Na2O2加入H2O中:Na2O2+H2O=2Na++2OH-+O2↑
B.向Al2(SO4)3溶液中加入过量的氨水:Al3++4NH3?H2O=AlO2-+4NH4++2H2O
C.向Ba(OH)2溶液中滴加NaHSO4溶液至中性:Ba2++OH-+H++SO42-=BaSO4↓+H2O
D.向海带灰浸出液中加入硫酸、双氧水:2I-+2H++H2O2=I2+2H2O
参考答案:A.方程式左边3个氧原子,右边4个氧原子,左右氧原子不守恒,正确的为:2Na2O2+2H2O=4Na++4OH-+O2↑,故A错误;
B.氢氧化铝只能溶解强酸和强碱,不能溶解在氨水弱碱中,向Al2(SO4)3溶液中加入过量的氨水,只能生成氢氧化铝沉淀,正确的为:Al3++3NH3?H2O=Al(OH)3↓+3NH4+,故B错误;
C.向Ba(OH)2溶液中滴加NaHSO4溶液,Ba(OH)2溶液中钡离子和氢氧根离子比应为1:2,当氢离子和氢氧根离子恰好完全反应时溶液为中性,离子方程式为:Ba2++SO42-+2OH-+2H+=BaSO4↓+2H2O,故C错误;
D.向海带灰浸出液中加入硫酸、双氧水,双氧水具有氧化性,碘离子具有还原性,发生氧化还原反应,2I-+2H++H2O2=I2+2H2O,两边的各种原子的个数及电荷数相等,故D正确;
故选D.
本题解析:
本题难度:一般
2、选择题 在1L含0.1mol?NaAlO2和0.1mol?Ba(OH)2的混合溶液中,逐滴加入浓度为0.1mol/L的H2SO4溶液,下列图象中能表示反应产生沉淀的物质的量与加入硫酸溶液体积之间关系的是( )
A.

B.

C.
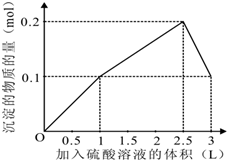
D.

参考答案:在1L含0.1mol?NaAlO2和0.1mol?Ba(OH)2的混合溶液中n(NaAlO2)=0.1mol,n[Ba(OH)2]=0.1mol,向该混合溶液中加入H2SO4溶液,首先发生反应Ba(OH)2+H2SO4=BaSO4↓+2H2O,Ba(OH)2反应完毕,继续加入H2SO4溶液,再发生反应AlO2-+H++H2O=Al(OH)3↓,AlO2-反应完毕,沉淀达最大,继续加入H2SO4溶液,发生反应Al(OH)3+3H+=Al3++3H2O,沉淀减少,Al(OH)3反应完毕,最后为BaSO4沉淀,继续加入H2SO4溶液,沉淀的量不变.
第一阶段:由发生反应Ba(OH)2+H2SO4=BaSO4↓+2H2O可知,Ba(OH)2反应完毕,需加入0.1molH2SO4,H2SO4溶液的体积为0.1mol0.1mol/L=1L,生成沉淀n(BaSO4)=0.1mol;
第二阶段:由发生反应AlO2-+H++H2O=Al(OH)3↓可知,0.1molAlO2-反应完毕,该阶段需加入0.05molH2SO4,H2SO4溶液的体积为0.05mol0.1mol/L=0.5L,该阶段生成沉淀n[Al(OH)3]=0.1mol,但加入相同体积的硫酸,该阶段比第一阶段生成沉淀的多,为第一阶段的2倍;
第三阶段:由发生反应Al(OH)3+3H+=Al3++3H2O可知,沉淀减少,0.1molAl(OH)3完全溶解,该阶段需加入0.1mol×32=0.15molH2SO4,H2SO4溶液的体积为0.15mol0.1mol/L=1.5L,沉淀n(BaSO4)=0.1mol.
由上述分析可知:
第一阶段产生沉淀n(BaSO4)=0.1mol,加入H2SO4溶液的体积为1L;
第二阶段又生成沉淀n[Al(OH)3]=0.1mol,此时沉淀总量为0.2mol,该阶段加入H2SO4溶液的体积为0.1L,此时加入H2SO4溶液的总体积为1.5L;
第三阶段0.1molAl(OH)3完全溶解,此时沉淀n(BaSO4)=0.1mol,该阶段加入H2SO4溶液的体积为1.5L,此时加入H2SO4的总体积为3L.
故沉淀的量与H2S O4溶液体积关系图为:
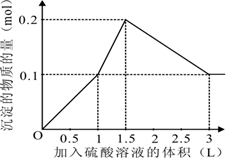
,
故选A.
本题解析:
本题难度:一般
3、选择题 将a L(标准状况)CO2通入100mL 3mol·L-1 NaOH溶液中,下列各项为通入CO2过程中溶液内发生反应的离子方程式,其中不正确的是?
A.a =3.36时,CO2 + 2OH- = CO32- + H2O
B.a =4.48时,2CO2 + 3OH- = CO32- + HCO3- + H2O
C.a =6.72时,CO2 + OH- = HCO3-
D.a =8.96时,3CO2 + 4OH- = CO32- + 2HCO3- + H2O
参考答案:D
本题解析:A、a=3.36时物质的量为:n(CO2)=0.15mol,n(NaOH)=0.3mol;n(CO2):n(NaOH)=0.15mol:0.3mol=1:2,反应离子方程式为:CO2+2OH-=CO32-+H2O;故A正确;
B、a=4.48时,物质的量为:n(CO2)=0.2mol,n(NaOH)=0.3mol;n(CO2):n(NaOH)=0.2mol:0.3mol=2:3,氢氧化钠和二氧化碳恰好反应生成碳酸钠和碳酸氢钠,反应离子方程式可以直平法写出为:2CO2+3OH-=CO32-+HCO3-+H2O,故B正确;
C、a=6.72时物质的量为:n(CO2)=0.3mol,n(NaOH)=0.3mol;n(CO2):n(NaOH)=0.3mol:0.3mol=1:1,反应离子方程式为:CO2+OH-=HCO3-;故C正确;
D、a=8.96时物质的量为:,n(CO2)=0.4mol,n(NaOH)=0.3mol;n(CO2):n(NaOH)=0.4mol:0.3mol=4:3,n(CO2):n(NaOH)>1:1,反应离子方程式为::CO2+OH-=HCO3-;故D错误。
故选D。
点评:本题考查了定量计算的离子方程式的书写方法和产物判断,主要是量不同产物不同的产物判断是解题关键。
本题难度:一般
4、选择题 下列能正确表示相应过程的离子方程式的是(?)
A.纯碱显碱性的原因:CO32-+ 2 H2O = H2CO3 + 2 OH-
B.稀盐酸和稀氢氧化钠溶液反应的中和热△H=-57.3 kJ/mol,则稀硫酸与稀氢氧化钾溶液发生反应的热化学方程式表示为:
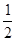 H2SO4(l)+ KOH(l) =
H2SO4(l)+ KOH(l) = 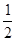 K2SO4 (l)+ H2O(l) △H=-57.3 kJ/mol
K2SO4 (l)+ H2O(l) △H=-57.3 kJ/mol
C.明矾溶液中滴加氢氧化钡溶液至沉淀的物质的量最大:
2 Al3+ +3 SO42-+3 Ba2+ +6 OH- =" 2" Al(OH)3 ↓+ 3 BaSO4 ↓
D.铜和浓硫酸混合加热:2H2SO4(浓)+Cu SO2↑+Cu2+ +SO42-+2 H2O
SO2↑+Cu2+ +SO42-+2 H2O
参考答案:C
本题解析:A、纯碱显碱性的原因:CO32-+ H2O = HCO3- + OH-,错误;B、稀盐酸和稀氢氧化钠溶液反应的中和热△H=-57.3 kJ/mol,则稀硫酸与稀氢氧化钾溶液发生反应的热化学方程式表示为:
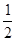 H2SO4(aq)+ KOH(aq) =
H2SO4(aq)+ KOH(aq) = 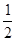 K2SO4 (aq)+ H2O(l) △H=-57.3 kJ/mol,错误;C、正确;D、铜和浓硫酸混合加热,生成的硫酸铜是白色的,原因是水太少,没有电离成离子状态:
K2SO4 (aq)+ H2O(l) △H=-57.3 kJ/mol,错误;C、正确;D、铜和浓硫酸混合加热,生成的硫酸铜是白色的,原因是水太少,没有电离成离子状态:
2H2SO4(浓)+Cu SO2↑+CuSO4+2 H2O。
SO2↑+CuSO4+2 H2O。
本题难度:一般
5、选择题 下列离子方程式正确的是( )
A.锌和稀硝酸的反应:Zn+2H+═Zn2++H2↑
B.氯气和水的反应:Cl2+H2O═2H++Cl-+ClO-
C.向硫酸铝溶液中滴加过量的氢氧化钡溶液2Al3++3SO42-+3Ba2++8OH-═2AlO2-+3BaSO4↓+4H2O
D.向次氯酸钠溶液中通入足量SO2气体:ClO-+SO2+H2O═HClO+HSO3-
参考答案:A.锌和稀硝酸的反应的离子反应为3Zn+8H++2NO3-═3Zn2++2NO↑+4H2O,故A错误;
B.氯气和水的反应的离子反应为Cl2+H2O═H++Cl-+HClO,故B错误;
C.向硫酸铝溶液中滴加过量的氢氧化钡溶液的离子反应为2Al3++3SO42-+3Ba2++8OH-═2AlO2-+3BaSO4↓+4H2O,故C正确;
D.向次氯酸钠溶液中通入足量SO2气体的离子反应为ClO-+SO2+H2O═2H++Cl-+SO42-,故D错误;
故选C.
本题解析:
本题难度:简单