微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 从海水中可以获得淡水、食盐,并可提取镁和溴等物质.
(一)海水淡化的方法主要有______(填一种).
(二)从海水中提取溴和镁的流程如图所示:
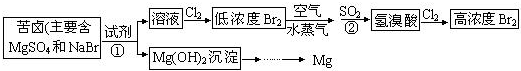
(1)提取Br2时,第一次通入Cl2后发生反应的离子方程式是______;②中SO2表现______(填“氧化”或“还原”)性;第二次通入Cl2后,要提取Br2还要进行的操作为______.
(2)为了实现对镁离子的富集,①中加入的足量试剂是______(填化学式);
试从节约能源,提高金属镁的纯度分析,以下最适宜的冶炼的方法是______(填字母).
A.Mg(OH)2
MgOMg
B.Mg(OH)2MgOMg
C.Mg(OH)2无水MgCl2Mg
D.Mg(OH)2MgCl2溶液Mg.
参考答案:(一)淡化海水,应将水与海水中的盐进行分离,常用方法有蒸馏、电渗析以及离子交换法等,最简单的是蒸馏的方法,故答案为:蒸馏;
(二)向苦卤中加入试剂①得到Mg(OH)2,且不能引入新的杂质离子,则①应该是NaOH,Mg(OH)2溶于稀盐酸得到MgCl2溶液,将MgCl2.6H2O在HCl氛围中脱水得到MgCl2,电解熔融MgCl2得到Mg;
向溶液中通入过量Cl2,发生反应2Br-+Cl2=2Cl-+Br2,得到低浓度的Br2,用热空气将Br2吹出,然后用二氧化硫还原溴得到溴离子,反应方程式为SO2+2H2O+Br2=H2SO4+2HBr,向氢溴酸中通入氯气,发生反应2Br-+Cl2=2Cl-+Br2,从而得到高浓度的Br2,
(1)通过以上分析知,提取Br2时,第一次通入Cl2后发生反应的离子方程式是2Br-+Cl2=2Cl-+Br2;②中发生的反应为SO2+2H2O+Br2=H2SO4+2HBr,S元素化合价由+4价变为+6价,所以SO2表现还原性;从溴水中获取溴单质采用萃取的方法,所以第二次通入Cl2后,要提取Br2还要进行的操作为萃取,
故答案为:2Br-+Cl2=2Cl-+Br2;还原;萃取;
(2)通过以上分析知,为了实现对镁离子的富集,①中加入的足量试剂是NaOH,
A.氧化镁熔点很高,电解熔融态氧化镁会增加成本,故不适合;
B.真空、高温还原MgO增加成本,且条件难以控制,故不适合;
C.镁是活泼金属,采用电解熔融氯化镁的方法冶炼镁,故适合;
D.镁是活泼金属,不能采用置换法获取,故不适合;
故选C;
故答案为:NaOH;C.
本题解析:
本题难度:一般
2、填空题 (三选一)【选修2:化学与技术】
海水资源的利用具有广阔前景。海水中主要离子的含量如下:

(1)电渗析法淡化海水示意图如图所示,其中阴(阳)离子交换膜仅允许阴(阳)离子通过。

①阳极主要电极反应式是________________。
②在阴极附近产生少量白色沉淀,其成分有_______和CaCO3,生成CaCO3的离子方程式是____________________。
③淡水的出口为________(填“a”、“b”或“c”)。
(2)利用海水可以提取溴和镁,提取过程如下:
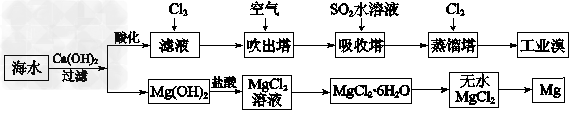
①提取溴的过程中,经过2次Br-→Br2转化的目的是_________________,吸收塔中发生反应的离子方程式是_______________。用平衡移动原理解释通空气的目的是_________________________。
②从MgCl2溶液中得到MgCl2·6H2O晶体的主要操作是_________、过滤、洗涤、干燥。
③依据上述流程,若将10?m3海水中的溴元素转化为工业溴,至少需要标准状况下Cl2的体积为______L(忽略Cl2溶解)。
参考答案:(1)①2Cl--2e-=Cl2↑;②Mg(OH)2;Ca2++?OH-+HCO3-=CaCO3↓+H2O;③b
(2)①对溴元素进行富集;SO2+Br2+2H2O=4H++2Br-+SO42-;通空气将Br2蒸气带出使Br2(g) Br2(aq)或Br2+H2O
Br2(aq)或Br2+H2O HBr+HBrO平衡向左移动;②加热浓缩、冷却结晶;③179.2
HBr+HBrO平衡向左移动;②加热浓缩、冷却结晶;③179.2
本题解析:
本题难度:一般
3、选择题 水资源非常重要,联合国确定2003年为国际淡水年。下列关于水的说法中错误的是
[? ]
A.蒸馏法是海水淡化的方法之一
B.淡水的密度小于海水的密度
C.融化的雪水中矿物质含量比深井水中的少
D.0℃以上,温度越高,水的密度越小
参考答案:D
本题解析:
本题难度:简单
4、填空题 空气吹出法工艺,是目前“海水提溴”的最主要方法之一。其工艺流程如下
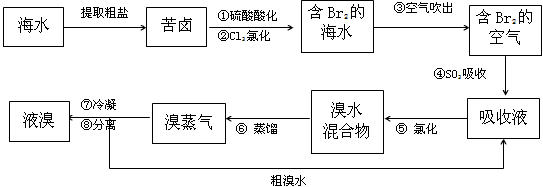
(1)溴在周期表中位于______周期,______族。
(2)步骤④的离子方程式:______________________________。
(3)已知溴的沸点是58.5℃,步骤⑥的蒸馏过程中,溴出口温度为何要控制在80-90℃。温度过高或过低都不利于生产____________,请解释原因:________________________。
(4)步骤⑧中溴蒸气冷凝后得到液溴与溴水的混合物,可利用它们的相对密度相差很大的特点进行分离。若在实验室分离上述混合物的分离仪器的名称是____________,分离时液溴从分离器的_________(填“上口”或“下口”)排出。
(5)为什么不直接用含溴的海水进行蒸馏得到液溴,而要经过“空气吹出、SO2吸收、氯化”:________________________________________________。
参考答案:(1)第四;ⅦA
(2)Br2+SO2+2H2O=4H++2Br-+ SO42-
(3)温度过高,大量水蒸气排出,溴气中水增加;温度过低,溴不能完全蒸出,吸收率低
(4)分液漏斗;下口
(5)氯化后的海水虽然含有溴单质,但浓度低,如果直接蒸馏原料,产品成本高,“空气吹出、SO2吸收、氯化”的过程实际上是一个Br2的富集过程
本题解析:
本题难度:一般
5、选择题 由海水制备无水氯化镁,主要有以下步骤:①在一定条件下脱水干燥;②加熟石灰;③加盐酸;④过滤;⑤浓缩结晶。其先后顺序正确的是
[? ]
A.②④⑤③①
B.③②④①⑤
C.③④②⑤①
D.②④③⑤①
参考答案:D
本题解析:
本题难度:简单