微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (16分)甲醇又称“木醇”或“木精”,沸点64.7℃,是无色有酒精气味易挥发的液体。甲醇有毒,误饮5~10mL能双目失明,大量饮用会导致死亡。甲醇是重要的化学工业基础原料和液体燃料,可用于制造甲醛和农药,并常用作有机物的萃取剂和酒精的变性剂等。
(1)工业上可利用CO2和H2生产甲醇,方程式如下:
CO2(g)+3H2(g) CH3OH(l)+H2O (g) △H=Q1kJ·mol-1
CH3OH(l)+H2O (g) △H=Q1kJ·mol-1
又查资料得知:①CH3OH(l)+1/2 O2(g) CO2(g)+2H2(g)△H=Q2kJ·mol-1
CO2(g)+2H2(g)△H=Q2kJ·mol-1
②H2O(g)=H2O(l) △H= Q3kJ·mol-1,则表示甲醇的燃烧热的热化学方程式为 。
(2)工业上可用CO和H2O (g) 来合成CO2和H2,再利用(1)中反应原理合成甲醇。某温度下,将1molCO和1.5molH2O充入10L固定密闭容器中进行化学反应:CO(g)+H2O(g) CO2(g)+H2(g) △H>0,当反应进行到10min时达到平衡,此时测得H2为0.6 mol。回答下列问题:
CO2(g)+H2(g) △H>0,当反应进行到10min时达到平衡,此时测得H2为0.6 mol。回答下列问题:
①0~10min内H2O(g)的平均反应速率为 。
②若想加快正反应速率的同时提高CO的转化率,可以采用的方法是 。
a.升高温度 b.缩小容器的体积
c.增大H2O (g)的浓度 d.加入适当的催化剂
③若保持温度容积不变再向其中充入1molCO和0.5molH2O(g),重新达到化学平衡状态时,此时平衡混合气体中H2的体积分数为 。
(3)甲醇燃料电池是符合绿色化学理念的新型燃料电池,下图是以甲醇燃料电池(甲池)为电源的电解装置。已知:A、B、C、D、E、F都是惰性电极,丙中为0.1 mol/L CuSO4溶液 (假设反应前后溶液体积不变),当向甲池通入气体a和b时,D极附近呈红色。回答下列问题:
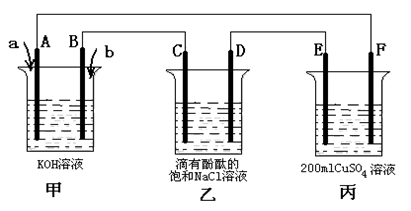
① a物质是 ,A电极的电极反应式为 。
② 乙装置中的总化学反应方程式为 。
③ 当乙装置中C电极收集到224mL(标况下)气体时, 丙中溶液的pH= 。
参考答案:(16分)(每空2分)(1)CH3OH(l)+3/2 O2(g) = CO2(g)+2H2O(l) ΔH=(2Q1+3Q2+2Q3)kJ/mol
(2)① 6×10-3 mol·L-1·min-1 ②ac ③ 25%
(3)① CH3OH; CH3OH - 6e- + 8OH- = CO32- + 6H2O
② 2NaCl + 2H2O  2NaOH + Cl2↑+ H2 ↑ ③ 1
2NaOH + Cl2↑+ H2 ↑ ③ 1
本题解析:(1)已知反应:① CO2(g)+3H2(g) CH3OH(l)+H2O (g) △H=Q1kJ·mol-1,② CH3OH(l)+1/2 O2(g)
CH3OH(l)+H2O (g) △H=Q1kJ·mol-1,② CH3OH(l)+1/2 O2(g) CO2(g)+2H2(g)△H=Q2kJ·mol-1,③ H2O(g)=H2O(l) △H= Q3kJ·mol-1,则根据盖斯定律可知2×①+3×②+2×③即可得到甲醇的燃烧热的热化学方程式为CH3OH(l)+3/2 O2(g) = CO2(g)+2H2O(l) ΔH=(2Q1+3Q2+2Q3)kJ/mol。
CO2(g)+2H2(g)△H=Q2kJ·mol-1,③ H2O(g)=H2O(l) △H= Q3kJ·mol-1,则根据盖斯定律可知2×①+3×②+2×③即可得到甲醇的燃烧热的热化学方程式为CH3OH(l)+3/2 O2(g) = CO2(g)+2H2O(l) ΔH=(2Q1+3Q2+2Q3)kJ/mol。
(2)①当反应进行到10min时达到平衡,此时测得H2为0.6 mol,则根据方程式可知消耗水蒸气是0.6mol,水蒸气浓度变化量是0.6mol÷10L=0.06mol/L,实验用氢气表示的反应速率为0.06mol/L÷10min=6×10-3 mol·L-1·min-1。
②a.正方应是吸热反应,则升高温度反应速率加快,平衡向正反应方向进行,CO的转化增大,a正确; b.反应前后体积不变,则缩小容器的体积压强增大,反应速率较加快,淡平衡不移动,CO转化率不变,b错误;c.增大H2O (g)的浓度正反应速率增大,平衡向正反应方向进行,则CO转化率增大,c正确; d.加入适当的催化剂反应速率加快,但平衡不移动,CO转化率不变,d错误,答案选ac。
③若保持温度容积不变再向其中充入1molCO和0.5molH2O(g),由于温度不变,则平衡常数不变,所以
CO(g)+H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g)
起始浓度(mol/L) 0.2 0.2 0 0
转化浓度(mol/L) x x x x
破坏你的(mol/L) 0.2-x 0.2-x x x
所以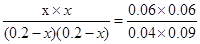
解得x=0.1
所以此时平衡混合气体中H2的体积分数为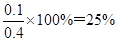
(3)①D极附近呈红色,这说明D电极周围产生氢氧根离子,即D电极是阴极氢离子放电,则A是负极。原电池中负极失去电子,则A通入的物质是CH3OH,电解质是氢氧化钾,则负极电极反应式为CH3OH - 6e- + 8OH-=CO32- + 6H2O。
②乙装置是电解饱和食盐水,则电解的总反应式为2NaCl + 2H2O  2NaOH + Cl2↑+ H2↑。
2NaOH + Cl2↑+ H2↑。
③当乙装置中C电极是阳极,氯离子放电生成氯气,如果收集到224mL(标况下)气体即氯气是0.01mol,则转移0.02mol电子,所以根据电子转移守恒可知丙装置中产生0.02mol氢离子,氢离子浓度是0.02mol÷0.2L=0.1mol/L,则丙中溶液的pH=1。
考点:考查盖斯定律应用、反应速率、平衡常数计算与应用、外界条件对平衡状态的影响以及电化学原理的应用等
本题难度:困难
2、选择题 (2014届上海市六校高三第二次联考化学试卷)
铁棒和石墨棒用导线连接后,浸入0.01mol/L的氯化钠溶液中,可能出现的现象是
A.铁棒附近产生OH-
B.铁棒质量减少
C.石墨棒上放出氢气
D.石墨棒上放出氧气
参考答案:B
本题解析:
铁棒和石墨棒用导线连接后,浸入0.01mol/L的氯化钠溶液形成了原电池,由于活动性Fe>C。所以Fe作负极,发生的电极反应为Fe-2e-=Fe2+。C作正极。因为是中性溶液,所以在正极上发生反应:O2+4e-+2H2O=4OH-。在溶液中2Fe +O2+2H2O=2Fe(OH)2.
4Fe(OH)2+O2+2H2O=4Fe(OH)3.所以Fe会减少。在C棒附近产生OH-。正确选项为B。
本题难度:一般
3、选择题 热激活电池可用作火箭、导弹的工作电源。一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能。该电池的总反应方程式为:PbSO4+2LiCl+Ca = CaCl2+Li2SO4+Pb。
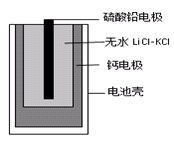
下列有关说法正确的是
A.正极反应式:Ca +2Cl--2e-=CaCl2
B.放电过程中,Li+向负极移动
C.每转移0.1mol电子,理论上生成20.7gPb
D.常温时,在正负极间接上电流表或检流计,指针不偏转