微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 (10分)实验室需要480 mL 0.4 mol·L-1的NaCl溶液,有如下操作步骤:
①把称量好的NaCl晶体放入小烧杯中,加适量蒸馏水溶解。
②把①所得溶液小心转入一定容积的容量瓶中。
③继续向容量瓶中加蒸馏水至液面距刻度线1 cm~2 cm处,改用胶头滴管小心滴加蒸馏水至溶液凹液面与刻度线相切。
④用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次洗涤的液体都小心转入容量瓶,并轻轻摇匀。
⑤将容量瓶瓶塞塞紧,充分摇匀。
请填写下列空白:
(1)操作步骤的正确顺序为(填序号)________。
(2)实验室有如下规格的容量瓶:①100 mL,②250 mL,③500 mL,④1 000 mL,本实验选用________(填序号)。
(3)本实验用到的基本实验仪器除容量瓶、玻璃棒外还有:________________________。
(4)需要使用玻璃棒的操作有________(填序号),其作用为________________________。
(5)误差分析:(填“偏高”、“偏低”或“无影响”)
①称量NaCl时,物码倒置(1 g以下用游码):________。
②某同学观察液面的情况如图所示:__________________。
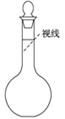
③没有进行操作步骤④:________。
④加蒸馏水时不慎超过了刻度线,立即用胶头滴管将多余的水吸出:________。
⑤容量瓶原来有少量水:____________。
参考答案:(1)①②④③⑤? (2)③
(3)托盘天平(带砝码)、药匙、烧杯、胶头滴管、量筒
(4)①②③④ 搅拌和引流
(5)①偏低 ②偏高 ③偏低 ④偏低 ⑤无影响
本题解析:(1)配制一定物质的量浓度的溶液步骤为:计算、称量、溶解、转移、洗涤、定容、摇匀,装瓶贴签。所以正确的操作步骤为①②④③⑤。(2)要配制480mL的溶液要选择500mL容量瓶。(3)本实验除用到容量瓶、玻璃棒外还有托盘天平(带砝码)、药匙、烧杯、胶头滴管、量筒。(4)需要使用玻璃棒的操作有溶解、转移、洗涤,玻璃棒的作用是搅拌和引流。(5)根据c=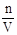 ,①称量NaCl时,物码倒置,NaCl质量比正常值小,所以溶质的质量比正常值小,偏低;②俯视页面,溶液的体积比正常值小,偏高;③没有进行洗涤,溶质比正常值小,偏低;④加蒸馏水时不慎超过了刻度线,溶液的体积比正常值高,偏低;⑤容量瓶原来有少量水,溶质的量和溶液的体积都不受影响,浓度不变。
,①称量NaCl时,物码倒置,NaCl质量比正常值小,所以溶质的质量比正常值小,偏低;②俯视页面,溶液的体积比正常值小,偏高;③没有进行洗涤,溶质比正常值小,偏低;④加蒸馏水时不慎超过了刻度线,溶液的体积比正常值高,偏低;⑤容量瓶原来有少量水,溶质的量和溶液的体积都不受影响,浓度不变。
点评:这类习题是专项考查一定物质的量浓度的习题,难度较低,比较基础。
本题难度:一般
2、计算题 130g Zn与一定量的H2SO4恰好完全反应后得溶液500ml,密度为1.61g/ml,求所得溶液的溶质的物质的量浓度和溶质的质量分数?
参考答案:设生成的ZnSO4为xg,则
Zn+H2SO4=ZnSO4+H2↑
65? 161
130? x
x=322g
由m=n·M?所以n=2mol
由c=n/V?所以c=4mol/LW%( ZnSO4)=322/(500×1.61)=40%
本题解析:考查一定物质的量浓度溶液的配制。
本题难度:一般
3、选择题 将4gNaOH固体溶解在水里,配得1L溶液,溶液的物质的量浓度是
[? ]
A.10 mol/L
B.1mol/L
C.0.1 mol/L
D.0.01 mol/L
参考答案:C
本题解析:
本题难度:简单
4、选择题 设NA代表阿伏加德罗常数(NA)的数值,下列说法正确的是
A.1 mol硫酸钾中阴离子所带电荷数为NA
B.乙烯(C2H4)和环丙烷(C3H6)组成的28 g混合气体中含有2NA个氢原子
C.1mol Na2O2固体中含有NA个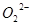
D.将含0.1 mol氯化铁的饱和溶液滴加到沸水中可制取0.1NA个 Fe(OH)3胶体微粒
参考答案:C
本题解析:考查阿伏加德罗常数的应用。1 mol硫酸钾中阴离子所带电荷数为2NA,选项A不正确;乙烯(C2H4)和环丙烷(C3H6)的最简式相同,都是CH2,所以28 g混合气体中含有4NA个氢原子,选项B不正确;氯化铁与水反应制取胶体的反应是可逆的,选项D不正确,答案选C。
本题难度:一般
5、选择题 今有一包铁粉和铜粉混合粉末,为确定其组成,现提供4 mol·L-1的FeCl3溶液(其它用品略),某合作学习小组同学的实验结果如下(假定反应前后溶液体积不变):
组别
| ①
| ②
| ③
| ④
|
V[FeCl3(aq)]/mL
| 100
| 100
| 100
| 100
|
混合粉末质量/g
| 6
| 13.2
| 24
| 36
|
反应后剩余固体质量/g
| 0
| 1.28
| 12.8
| 24.8
|
?
下列结论正确的是(?)
A.第①组反应后溶液中c(Fe3+) =" 3.0" mol·L-1
B.第②组剩余固体是铜铁混合物
C.第④组反应后的滤液中c(Fe2+) =" 6" mol·L-1
D.原混合粉末中n(Fe)∶n(Cu) = 3∶2
参考答案:C
本题解析:根据第③④两组反应减少的固体的质量相等,可知该条件下均是铁把FeCl3溶液完全反应,反应铁的质量为11.2g,物质的量为0.2mol,第④组反应后的滤液中c(Fe2+) = (0.4+0.2)÷0.1="6" mol·L-1, 第②组溶解的固体为11.92g大于11.2g,故应有铜溶解,剩余物质为未反应完全的铜,
设第②组反应的铁和铜的物质的量分别为x、y,
根据反应方程式有2x+2y=0.4,根据质量关系为56x+64y=13.2-1.28=11.92,
联合解为x=0.11mol,y=0.09mol所以铜的量为0.09+1.28÷64=0.11mol,铁的物质的量为0.11mol
n(Fe)∶n(Cu) = 1∶1;
第①组反应中6g金属中n(Fe)="n(Cu)" = 0.05mol,反应中共消耗FeCl3的量为n(FeCl3)= 2n(Fe)+2n(Cu)=0.2mol,反应后溶液中n(Fe3+) = 0.6-0.2="0.4" mol ,c(Fe3+) =" 4.0" mol·L-1
故答案为 C。
本题难度:一般