微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (12分)
(1)现有标准状况下的氮气5.6g,其体积为 ,含有氮分子的数目为
(2)标准状况下,2mol NH3与________g CO2的体积相等。
(3)等质量的O2和O3所含的原子个数之比是______________。
(4)实验室使用的浓盐酸的溶质的质量分数一般为36.5%,密度为1.19g/cm-3,
将 升氯化氢(标准状况)通入1.00L水中 可得36.5%的浓盐酸,该浓盐酸的物质的量浓度为 。
可得36.5%的浓盐酸,该浓盐酸的物质的量浓度为 。
参考答案:(12分)每空2分
(1) 4.48L;0.2NA(或1.204×1023) (2)88g
(3)1:1 (4)353L;11.9 mol ·L-1
本题解析:略
本题难度:一般
2、选择题 下列说法中正确的是( )
A.将0.1molCuSO4?5H2O晶体加入到100mL水中,该溶液物质的量浓度为1mol?L-1
B.一定体积的浓硫酸(其中含0.2molH2SO4)与足量的铜共热反应,生成SO2气体0.1mol
C.将34.2gAl2(SO4)3溶于水配成100mL溶液[Al2(SO4)3的相对质量为342J,取出10mL该溶液中Al3+浓度为1mol?L-1
D.KCl溶液的密度为1.174g?cm-3,物质的量浓度为4.0mol?L-1,则此溶液中KCl的质量分数为
×100%
参考答案:A.将0.1molCuSO4?5H2O晶体溶于水配成100mL溶液,溶液物质的量浓度为1mol?L-1,物故A错误;
B.Cu与浓硫酸反应,随反应进行,浓硫酸变稀,而稀硫酸不与Cu反应,由Cu+2H2SO4(浓)△.CuSO4+SO2↑+2H2O可知,含0.2molH2SO4的浓硫酸与足量的铜共热反应,生成SO2气体小于0.1mol,故B错误;
C.34.2gAl2(SO4)3的物质的量为0.1mol,于水配成100mL溶液,所得Al2(SO4)3溶液浓度为1mol/L,溶液时均匀的,取出10mL溶液的浓度与原溶液浓度相等,由于Al3+水解,其浓度小于2mol/L,故C错误;
D.KCl溶液的密度为1.174g?cm-3,物质的量浓度为4.0mol?L-1,根据c=1000ρWM可知,此溶液中KCl的质量分数为74.5×4.01.174×1000×100%,故D正确,
故选D.
本题解析:
本题难度:一般
3、选择题 哥本哈根气候大会的中心议题是“节能减排”,美国二氧化碳排放量居世界之首,人均年排放CO2约20吨,20吨CO2在标准状况下的体积为
A.2×107L
B. L
L
C.2×107×22.4 L
D. ×22.4 L
×22.4 L
参考答案:D
本题解析:以“节能减排”为知识背景,实际是以物质的量为中心的计算。先求20吨二氧化碳的物质的量: ,再求标准状况下的体积:
,再求标准状况下的体积: ,故选D
,故选D
点评:物质的量为中心的计算中,要熟练掌握这些公式: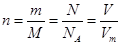 。试题基础、简单。
。试题基础、简单。
本题难度:一般
4、计算题 某温度下,22%NaNO3溶液150mL,加100g水稀释后质量分数变为14%,求原NaNO3溶液的物质的量浓度。 (结果保留两位小数)
参考答案:3.02mol/L
本题解析:
本题难度:一般
5、简答题 将5.0LNaCl溶液和3.0LBaCl2溶液混和,设混和后总体积为8.0L,并测得NaCl物质的量浓度为0.50mol?L-1,BaCl2物质的量浓度为0.30mol?L-1.问:
(1)混合溶液中Cl-物质的量浓度为多少?
(2)混合前NaCl溶液中NaCl的物质的量浓度为多少?
参考答案:(1)n(NaCl)=0.50?mol?L-1×8.0?L=4.0?mol,
n(BaCl2)=0.30?mol?L-1×8.0?L=2.4?mol,
则混合后Cl-物质的量为4.0mol+2.4mol×2=8.8mol,
混合后总体积为8.0L,
则混合溶液中Cl-物质的量浓度为8.8mol8.0L=1.1mol/L,
答:混合溶液中Cl-物质的量浓度为1.1mol/L;
(2)n(NaCl)=0.50?mol?L-1×8.0?L=4.0?mol,
氯化钠的物质的量在混合前后相等,混合前NaCl溶液的体积为5.0L,
则混合前NaCl溶液中NaCl的物质的量浓度为4.0mol5.0L=0.8mol/L,
答:混合前NaCl溶液中NaCl的物质的量浓度为0.8mol/L.
本题解析:
本题难度:一般