微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列电离方程式中,错误的是
[? ]
A、NaHCO3 Na++ HCO3-
Na++ HCO3-
B、NaHS = Na++H++S2-
C、NaHSO4 = Na++H++SO42-
D、CH3COOH H++ CH3COO-
H++ CH3COO-
参考答案:B
本题解析:
本题难度:简单
2、实验题 用中和滴定法确定某烧碱样品的浓度,试根据实验回答下列问题:
(1)准确称取一定量的样品,配成500 mL待测溶液。称量时,样品可放在 (填编号字母)上称量
(A)小烧杯 (B)洁净纸片 (C)直接放在托盘上
(2)准确量取10.00ml待测液于锥形瓶中,用0.2000mol·L-1的盐酸来滴定待测溶液,不可选用 (填编号字母)作指示剂。 (A)甲基橙 (B)石蕊 (C)酚酞
(3)若选用甲基橙作指示剂,滴定终点的判断依据是
此时溶液显 性。
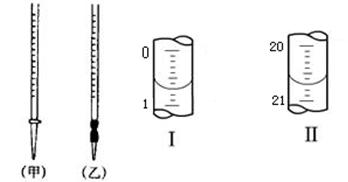
(4)0.2000mol·L-1的盐酸应装在下图所示的 (填甲、乙)中,图Ⅰ所示为滴定前液面,图Ⅱ所示为滴定结束时液面,根据图示计算被测烧碱溶液的物质的量浓度是 mol·L-1。
(5)下列实验操作会对滴定结果产生的后果。(填“偏高”、“偏低”或“无影响”)
①观察酸式滴定管液面时,开始俯视,滴定终点平视,则滴定结果 。
②若将锥形瓶用待测液润洗,然后再加入10.00mL待测液,则滴定结果 。
参考答案:(1)(A) (2)(B)
(3)当加入最后一滴标准的酸液时,溶液刚好由黄色变为橙色,且半分钟无变化 酸
(4)甲 0.4000 (5)①偏高 ②偏高
本题解析:(1)氢氧化钠是易潮解的物质,所以称量时必须要用烧杯或表面皿。
(2)石蕊的变色范围为5—8,变色范围较大,不适宜做指示剂。
(3)酸滴碱用甲基橙做指示剂,甲基橙的颜色由黄变为橙色,所以滴定终点的判断依据是当加入最后一滴标准的酸液时,溶液刚好由黄色变为橙色,且半分钟无变化,甲基橙的变色范围是3.1-4.4,此时溶液呈酸性。
(4)盐酸应该用酸式滴定管盛装,因此选择甲。如图可以看出所用酸的体积为20.00mL,根据c(H+)V(H+)= c(OH-)V(OH-),可以求出NaOH的浓度为0.4000。
(5)c(OH-)= ,开始俯视,滴定终点平视,所用HCl的体积比正常值大,所以偏高。若将锥形瓶用待测液润洗,然后再加入10.00mL待测液,所用HCl的体积比正常值大,所以偏高。
,开始俯视,滴定终点平视,所用HCl的体积比正常值大,所以偏高。若将锥形瓶用待测液润洗,然后再加入10.00mL待测液,所用HCl的体积比正常值大,所以偏高。
考点:酸碱中和滴定
点评:酸碱中和滴定是化学实验的基础题,其中要重视滴定终点的判断。
本题难度:一般
3、填空题 (3分)物质的量浓度均为0.1mol/L的下列溶液:①KNO3 、②Na2CO3 、③NaHCO3 、④NaHSO4 、⑤CH3COOH、⑥NaOH、⑦Ba(OH)2 ,pH由大到小的顺序为: 。
参考答案:(3分)、⑦⑥②③①⑤④
本题解析:硝酸钾是强酸强碱盐,溶液显中性;碳酸钠是强碱弱酸盐,水解显碱性;碳酸氢钠溶液中水解程度大于电离程度,所以所以显碱性;硫酸氢钠是强酸的酸式盐,溶液显强酸性;醋酸是弱酸,溶液显酸性;氢氧化钠是强碱,溶液显碱性;氢氧化钡是二元强碱,溶液显碱性,所以pH由大到小的顺序为⑦⑥②③①⑤④。
考点:考查溶液酸碱性强弱判断。
点评:在判断溶液的酸碱性时应该准确判断电解质的强弱以及盐类是否水解等。
本题难度:一般
4、选择题 下列电离方程式中,正确的是( )
A.Al2(SO4)3═2Al+3+3SO4-2
B.Na2CO3═Na2++CO32-
C.NaOH═Na++OH-
D.NaHCO3═Na++H++CO32-
参考答案:A、物质电离后角标要转化成化学计量数,同时注意离子所带的电荷数,正确的离子方程式为:Al2(SO4)3═2Al3++3SO42-,故A错误;
B、正确的离子方程式为:Na2CO3═2Na++CO32,故B错误;
C、氢氧化钠是强碱,在水溶液中完全电离出钠离子和氢氧根离子,故C正确;
D、碳酸氢钠能完全电离出钠离子和碳酸氢根离子,碳酸氢根离子是一个整体,不能再拆,NaHCO3═Na++HCO3-,故D错误.
故选C.
本题解析:
本题难度:一般
5、填空题 (10分)为测定NaOH溶液的浓度,实验如下:用标准稀盐酸溶液进行滴定
(1)配制100 mL 0.1000mol·L-1盐酸标准溶液所需仪器除量筒、小烧杯、玻璃棒、胶头滴管外,还需要
(2)用 量取20.00 mL待测NaOH溶液放入锥形瓶中,滴加2~3滴酚酞作指示剂,用标准盐酸溶液进行滴定。为减小实验误差,进行了三次实验,假设每次所取NaOH溶液体积均为20.00 mL,三次实验结果如下:
实验次数
| 第一次
| 第二次
| 第三次
|
消耗盐酸溶液体积/mL
| 19.00
| 23.00
| 23.04
|
该NaOH溶液的浓度约为____________________
(3)滴定时边滴边摇动锥形瓶,眼睛 ______
(4)下列操作会造成测定结果(待测NaOH溶液浓度值)偏低的有 _____
A.配制标准溶液定容时,加水超过刻度
B.锥形瓶水洗后直接装待测液
C.酸式滴定管水洗后未用标准稀盐酸溶液润洗
D.滴定到达终点时,俯视读出滴定管读数;
E.酸式滴定管尖嘴部分有气泡,滴定后消失
F.摇动锥形瓶时有少量液体溅出瓶外
参考答案:(1)100 mL容量瓶(写容量瓶1分)
(2)碱式滴定管(或移液管); 0.1151 mol·L-1(不写4位有效数字得1分)
(3)注视锥形瓶内溶液颜色的变化
(4)DF (各1分,错选0分)
本题解析:(1)配制100mL盐酸标准溶液,必须使用100mL容量瓶、烧杯、托盘天平、玻璃棒、胶头滴管等,所以答案:还需要100 mL容量瓶;(2)量取NaOH溶液用碱式滴定管;因第一次数据与其他两组相比差别较大,舍去。V(NaOH)=(23.00+23.04)÷2=23.02ml,
根据c(碱)= =
= =0.1151 mol·L-1;
=0.1151 mol·L-1;
(3)滴定时边滴边摇动锥形瓶,眼睛应注视锥形瓶内溶液颜色的变化;(4)A.配制标准溶液定容时,加水超过刻度,导致溶液浓度偏小,滴定时消耗体积偏大,则待测液浓度偏大;B.锥形瓶水洗后直接装待测液,对实验无影响;C.酸式滴定管水洗后未用标准稀盐酸溶液润洗,会导致盐酸浓度偏小,滴定时消耗体积偏大,测定值偏大;D.滴定到达终点时,俯视读出滴定管读数,会导致盐酸体积偏小,测定溶液浓度变小;E.酸式滴定管尖嘴部分有气泡,滴定后消失,测定盐酸体积偏大,测定溶液浓度偏大;F.摇动锥形瓶时有少量液体溅出瓶外,损失溶质,测定溶液浓度变小。答案DF。
考点:考查配制一定物质的量浓度的溶液及误差分析。
本题难度:一般