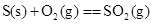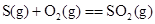微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的焓变,并采取相应措施.化学反应的焓变通常用实验进行测定,也可进行理论推算.
(1)实验测得,5g液态甲醇(CH3OH)在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5kJ的热量,试写出甲醇燃烧的热化学方程式______;
(2)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算.已知热化学方程式:
①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g);△H=-25kJ/mol
②3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g);△H=-47kJ/mol
③Fe3O4(s)+CO(g)=3FeO(s)+CO2(g);△H=+19kJ/mol
写出FeO(s)被CO还原成Fe和CO2的热化学方程式______;
(3)甲醇是一种清洁高效的能源,若将甲醇、氧气和氢氧化钾溶液设计成燃料电池,该电池正极反应式为:______.
参考答案:(1)5gCH3OH在氧气中燃烧生成CO2和液态水,放出113.5kJ热量,64g即1molCH3OH在氧气中燃烧生成CO2和液态水,放出1452.8kJ热量,
则热化学方程式为:2CH3OH(g)+3O2(g)═2CO2(g)+4H2O(l)△H=-1452.8KJ/
故答案为:2CH3OH(g)+3O2(g)═2CO2(g)+4H2O(l)△H=-1452.8KJ/mol
(2)①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g);△H=-25kJ/mol
②3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g);△H=-47kJ/mol
③Fe3O4(s)+CO(g)=3FeO(s)+CO2(g);△H=+19kJ/mol
依据盖斯定律①×3-(③×2+②)得到:
6CO(g)+6FeO(s)=6Fe(g)+6CO2(g)△H=-66KJ/mol;
得到热化学方程式为:CO(g)+FeO(s)=Fe(g)+CO2(g)△H=-11KJ/mol,
故答案为:CO(g)+FeO(s)=Fe(g)+CO2(g)△H=-11KJ/mol;
(3)碱性甲醇燃料电池中,该电池工作时,溶液中的OH-向负极移动,则总反应式为2CH3OH+3O2+4OH-=2CO32-+6H2O,负极发生氧化反应,电极反应式为CH3OH-6e-+8OH-+=CO32-+6H2O,正极发生还原反应,电极反应式为:O2+2H2O+4e-=4OH-,故答案为:O2+2H2O+4e-=4OH-;
本题解析:
本题难度:一般
2、填空题 1918年,Lewis提出反应速率的碰撞理论:反应物分子间的相互碰撞是反应进行的必要条件,但并不是每次碰撞都能引起反应,只有少数碰撞才能发生化学反应.能引发化学反应的碰撞称之为有效碰撞
(1)图I是HI分解反应中HI分子之间的几种碰撞示意图,其中属于有效碰撞的是______(选填“A”、“B”或“C”);
(2)图Ⅱ是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:______;
(3)E1的大小对该反应的反应热有无影响?______.(选填“有”或“无”)
(4)进一步研究表明,化学反应的能量变化(△H)与反应物和生成物的键能有关.键能可以简单的理解为断开1?mol?化学键时所需吸收的能量.下表是部分化学键的键能数据:
| 化学键 | C-H | Cl-Cl | C-Cl | H-Cl
键能/kJ?mol-1
X
243
330
432
|
已知:反应CH4(g)+Cl2(g)=CH3Cl(g)+HCl(g);△H=-106kJ/mol,则上表中X=______.

参考答案:(1)只有发生化学反应的碰撞才是有效碰撞,分析三个图,可知只有C有新物质生成,则C为有效碰撞,故答案为:C;
(2)反应热为134kJ/mol-368kJ/mol=-234kJ/mol,则反应的热化学方程式为NO2(g)+CO(g)=CO2(g)+NO(g)△H=-234 kJ/mol,
故答案为:NO2(g)+CO(g)=CO2(g)+NO(g)△H=-234 kJ/mol;
(3)E1是反应的活化能,反应焓变是和反应物和生成物有关于反应过程无关,不影响反应的反应热,故答案为:无;
(4)反应CH4(g)+Cl2(g)=CH3Cl(g)+HCl(g);△H=-106kJ/mol,反应焓变△H=4×C-H+Cl-Cl-(C-Cl+3×C-H+H-Cl)=-106,
4X+243-(330+3X+432)=-106计算得到X=413kJ/mol;
故答案为:413.
本题解析:
本题难度:一般
3、选择题 下列各组反应中,第一个反应放出的热量比第二个反应放出的热量多的是
(g、l、s分别表示气体、液体、固体) ( )
A.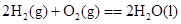
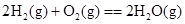
B.C(石墨)+O2(g)===CO2(g) C(金刚石)+O2(g)===CO2(g) (石墨比金刚石稳定)
C.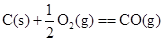
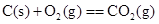
D.