|
高中化学知识点归纳《热化学方程式》高频试题特训(2017年最新版)(十)
2017-08-08 03:50:36
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 已知下列热化学方程式:(l) C(s)+1/2O2(g)=CO(g) △H =△H1
(2)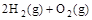 =2H2O(g) △H=△H2 =2H2O(g) △H=△H2
由此可知 C(s)+ H2O(g) == CO(g) + H2(g) ΔH3。则 ΔH3等于 ( )
A.△H1-△H2
B.△H1-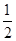 △H2 △H2
C.2△H1-△H2
D.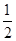 △H2 -△H1 △H2 -△H1
|
参考答案:B
本题解析:(l)—(2)*1/2 即得C(s)+ H2O(g) == CO(g) + H2(g) ,所以ΔH3=△H1-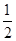 △H2 △H2
本题难度:简单
2、选择题 下列有关热化学方程式的表示及说法正确的是
[? ]
A.已知c(石墨,s)=c(金刚石,s)?△H>0,则金刚石比石墨稳定
B.已知I2(g)+H2(g)=2HI(g)?△H1;I2(s)+H2(g)=2HI(g)?△H2;则△H1<△H2
C.HCl和NaOH反应的中和热△H=-57.3kJ/mol,则H2SO4和Ba(OH)2反应的中和热△H=2×(-57.3)kJ/mol
D.已知H2(g)+F2(g)=2HF(g)?△H=-270kJ/mol,则2L氟化氢气体分解成1L氢气和1L氟气吸收270kJ热量
参考答案:B
本题解析:
本题难度:一般
3、填空题 (16分)制备氢气可利用碘硫热化学循环法,其原理示意图如下。

(1)已知:①2SO3(g) 2SO2 (g) + O2 (g) △H1 2SO2 (g) + O2 (g) △H1
②H2SO4(l) SO3(g) + H2O(l) △H2 SO3(g) + H2O(l) △H2
2H2SO4(l) 2SO2 (g) + O2(g) +2H2O(l) △H3 2SO2 (g) + O2(g) +2H2O(l) △H3
则△H3= (用△H1和△H2表示)
(2)上述热化学循环制氢要消耗大量的能量,从绿色化学角度,能量供应的方案是 。
(3)碘化氢热分解反应为:2HI(g) H2(g)+I2(g) △H>0。则该反应平衡常数表达式:K= ;升温时平衡常数K (选填“增大”或“减小”) H2(g)+I2(g) △H>0。则该反应平衡常数表达式:K= ;升温时平衡常数K (选填“增大”或“减小”)
(4)本生(Bunsen)反应中SO2和I2及H2O发生反应为:
SO2+I2+2H2O=3H++HSO4─+2I─;I─+I2 I3─。 I3─。
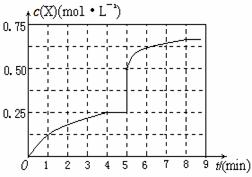
①当起始时,SO2为1mol,水为16mol,溶液中各离子变化关系如下图,图中a、b分别表示的离子是 、 。

②在水相中进行本生反应必须使水和碘显著过量,但易引起副反应将反应器堵塞。写出浓硫酸与HI发生反应生成硫和碘的化学方程式: 。
参考答案:(1)△H1+2△H2(2分)
(2)用廉价的清洁能源供给能量(用太阳能、风能、核能及生物质能等作为能源)(2分)
(3)c(H2)·c(I2)/c2(HI) (3分); 增大(2分);
(4)①H+、 I3- (各2分);②6HI+H2SO4(浓)=3I2↓+S↓+4H2O(3分)
本题解析:(1)①+②×2,整理可得2H2SO4(l) 2SO2 (g) + O2(g) +2H2O(l) △H3=△H1+2△H2;(2)上述热化学循环制氢要消耗大量的能量,从绿色化学角度,能量供应的方案是用廉价的清洁能源供给能量(用太阳能、风能、核能及生物质能等作为能源)(3)碘化氢热分解反应为:2HI(g) 2SO2 (g) + O2(g) +2H2O(l) △H3=△H1+2△H2;(2)上述热化学循环制氢要消耗大量的能量,从绿色化学角度,能量供应的方案是用廉价的清洁能源供给能量(用太阳能、风能、核能及生物质能等作为能源)(3)碘化氢热分解反应为:2HI(g) H2(g)+I2(g) △H>0。化学平衡常数是可逆反应达到平衡状态时,各种生成物浓度幂之积与各种反应物浓度幂之积的比。则该反应平衡常数表达式:K=c(H2)·c(I2)/c2(HI);由于该反应的正反应是吸热反应,根据平衡移动原理:升温时平衡向吸热的正反应方向移动,所以化学常数K增大;(4)①根据方程式中各种微粒的关系及图像显示的微粒的浓度变化可知:a表示的是H+;b表示的是I3-;②在水相中进行本生反应必须使水和碘显著过量,但易引起副反应将反应器堵塞。浓硫酸有强的氧化性,而HI有还原性,二者会发生氧化还原反应生成硫和碘,根据电子守恒和原子守恒,可得反应的化学方程式:6HI+H2SO4(浓)=3I2↓+S↓+4H2O。 H2(g)+I2(g) △H>0。化学平衡常数是可逆反应达到平衡状态时,各种生成物浓度幂之积与各种反应物浓度幂之积的比。则该反应平衡常数表达式:K=c(H2)·c(I2)/c2(HI);由于该反应的正反应是吸热反应,根据平衡移动原理:升温时平衡向吸热的正反应方向移动,所以化学常数K增大;(4)①根据方程式中各种微粒的关系及图像显示的微粒的浓度变化可知:a表示的是H+;b表示的是I3-;②在水相中进行本生反应必须使水和碘显著过量,但易引起副反应将反应器堵塞。浓硫酸有强的氧化性,而HI有还原性,二者会发生氧化还原反应生成硫和碘,根据电子守恒和原子守恒,可得反应的化学方程式:6HI+H2SO4(浓)=3I2↓+S↓+4H2O。
考点:考查化学方程式和热化学方程式的书写、化学方案的设计、化学平衡常数的表达及影响因素的知识。
本题难度:困难
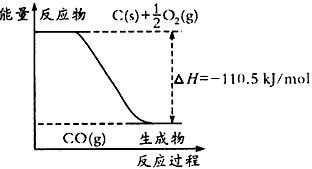
4、选择题 反应2C+O2=2CO的能量变化如下图所示。下列说法正确的是
[? ]
A.12g C(s)与一定量O2(g)反应生成14g CO(g),放出的热量为110.5 kJ
B.2 mol C(s)与足量O2(g)反应生成CO2(g),放出的热量大于221 kJ/mol
C.该反应的热化学方程式是:2C(s) +O2(g)=2CO(g) △H= -221kJ/mol
D.碳的燃烧热为110. 5 kJ/mol
参考答案:B
本题解析:
本题难度:简单
5、推断题 短周期元素A、B、C、D、E原子序数依次增大。A是周期表中原子半径最小的元素,B原子的价电子数等于该元素最低化合价的绝对值,C与D能形成D2C和D2C2两种化合物,而D是同周期中金属性最强的元素,E的负一价离子与C和A形成的某种化合物分子含有相同的电子数。
(1)A、C、D形成的化合物中含有的化学键类型为 。
(2)已知:①E-E→2E·;△H=+a kJ·mol-1
② 2A·→A-A;△H=-b kJ·mol-1
③E·+A·→A-E;△H=-c kJ·mol-1(“·”表示形成共价键所提供的电子)
写出298K时,A2与E2反应的热化学方程式 。
(3)在某温度下、容积均为2L的三个密闭容器中,按不同方式投入反应物,保持恒温恒容,使之发生反应:2A2(g)+BC(g) X(g);△H=-dJ·mol-1(d>0,X为A、B、C三种元素组成的一种化合物)。初始投料与各容器达到平衡时的有关数据如下: X(g);△H=-dJ·mol-1(d>0,X为A、B、C三种元素组成的一种化合物)。初始投料与各容器达到平衡时的有关数据如下:
实验
| 甲
| 乙
| 丙
| 初始投料
| 2 molA2、1 molBC
| 1 molX
| 4 molA2、2 molBC
| 平衡时n(X)
| 0.5mol
| n2
| n3
| 反应的能量变化
| 放出Q1kJ
| 吸收Q2kJ
| 放出Q3kJ
| 体系的压强
| P1
| P2
| P3
| 反应物的转化率
| α1
| α2
| α3
|
①在该温度下,假设甲容器从反应开始到平衡所需时间为4 min,则该时间段内A2的平均反应速率v(A2) 。
②该温度下此反应的平衡常数K的值为 。
③三个容器中的反应分别达平衡时各组数据关系正确的是 (填序号)。
A.α1+α2=1 B.Q1+Q2=d C.α3<α1
D.P3<2P1=2P2 E.n2<n3<1.0mol F.Q3=2Q1
④在其他条件不变的情况下,将甲容器的体系体积压缩到1L,若在第8min达到新的平衡时A2的总转化率为65.5%,请在下图中画出第5min 到新平衡时X的物质的量浓度的变化曲线。
参考答案:(1)离子键、共价键(2分)
(2)H2(g)+Cl2(g)=2HCl(g);△H=(a+b-2c)kJ·mol-1(2分)
(3)①0.125mol·L-1·min-1(2分)
②4(2分)
③ABD(3分)
④(3分)
本题解析:短周期元素A、B、C、D、E原子序数依次增大。A是原子半径最小的元素,则是H,B原子的价电子数等于该元素最低化合价的绝对值,则是C,C与D能形成D2C和D2C2两种化合物,而D是同周期中金属性最强的元素,C是O,D是Na,E的负一价离子与C和A形成的某种化合物分子含有相同的电子数,E是Cl;(1)A、C、D形成的化合物是NaOH,既有离子键,又有共价键;(2)根据盖斯定律,写出热方程H2(g)+Cl2(g)=2HCl(g);△H=(a+b-2c)kJ·mol-1(3)2H2+CO CH3OH,分别按照三次投料发生上述反应,条件相同,甲和乙是等效平衡,丙等同于增大压强,平衡正向移动。 CH3OH,分别按照三次投料发生上述反应,条件相同,甲和乙是等效平衡,丙等同于增大压强,平衡正向移动。
2 H2 + CO  CH3OH, CH3OH,
起始: 2 1 0
变化: 1 0.5 0.5
平衡: 1 0.5 0.5
①v(H2)= 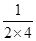 =0.125mol·L-1·min-1 ②K= =0.125mol·L-1·min-1 ②K=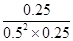 =4 =4
③根据甲乙等效平衡,A正确,B正确;丙中平衡右移,转化率增加,C.α3>α1,错误;压强小于2倍的甲的压强,D正确;2mol>n3>1mol,错误;Q3>2Q1答案ABD
考点:考查化学反应原理、平衡移动、等效平衡、计算
本题难度:困难
| 