|
高中化学知识点归纳《热化学方程式》高频试题特训(2017年最新版)(八)
2017-08-08 03:50:36
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列各组热化学方程式中,△H1>△H2的是
①C(s)+O2(g)===CO2(g) △H1 C(s)+1/2O2(g)===CO(g) △H2
②S(s)+O2(g)===SO2(g) △H1 S(g)+O2(g)===SO2(g) △H2
③H2(g)+1/2O2(g)===H2O(l) △H1 2H2(g)+O2(g)===2H2O(l) △H2
④CaCO3(s)==CaO(s)+CO2(g)△H1 CaO(s)+H2O(l)===Ca(OH)2(s)△H2
A.只有①
B.只有④
C.只有②③④
D.只有①②③
|
参考答案:C
本题解析:碳完全燃烧放热多,但放热越多,△H越小,①不正确。气态硫的能量高于固态S的能量,所以气态S燃烧放热多,②正确。参加反应的氢气越多,放热越多,所以③正确。④中前者是放热反应,后者是吸热反应,正确,答案选C。
本题难度:一般
2、填空题 (7分)某同学模拟工业“折点加氯法”处理氨氮废水的原理,进行如下研究。
装置(气密性良好,试剂已添加)
| 操作
| 现象
| 
| 打开分液漏斗活塞,逐滴加入浓氨水
|
|
参考答案:
本题解析:
本题难度:困难
3、简答题 磷在氧气中燃烧,可能生成两种固态氧化物.3.1g的单质磷(P)在3.2g的氧气中燃烧,至反应物耗尽,并放出XkJ热量.
(1)通过计算确定反应产物的组成(用化学式表示)是______,其相应质量(g)为______.
(2)已知单质磷的燃烧热为YkJ/mol,则1mol?P与O2反应生成固态P2O3的反应热△H=______.
(3)写出1molP与O2反应生成固态P2O3的热化学方程式:______.
参考答案:(1)3.1g的单质磷(P)的物质的量为3.1g31g/mol=0.1mol,3.2g的氧气的物质的量为3.2g32g/mol=0.1mol,故P原子与O原子的数目之比为0.1mol:0.1mol×2=1:2,2:5<1:2<2:3,故反应产物为P2O3、P2O5,令物质的量分别为xmol、ymol,则:
本题解析:
本题难度:一般
4、选择题 已知在1×105Pa,298K条件下,2mol氢气燃烧生成水蒸气放出484kJ热量,下列热化学方程式正确的是
[? ]
A.H2O(g)=H2(g)+1/2O2(g)ΔH=+242kJ·mol-1
B.2H2(g)+O2(g)=2H2O(l)ΔH=-484kJ·mol-1
C.H2(g)+1/2O2(g)=H2O(g)ΔH=+242kJ·mol-1
D.2H2(g)+O2(g)=2H2O(g)ΔH=+484kJ·mol-1
参考答案:A
本题解析:
本题难度:简单
5、填空题 运用化学反应原理研究氮、硫、氯、碘等单质及其化合物的反应有重要意义
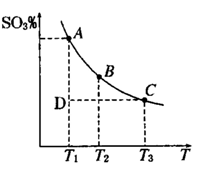
(1)硫酸生产中,SO2催化氧化生成SO3; 2SO2(g)+O2(g)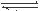 2SO3(g),混合体系中SO3 的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态).根据图示回答下列问题, 2SO3(g),混合体系中SO3 的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态).根据图示回答下列问题,
①2SO2(g)+O2(g)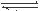 2SO3(g)的△H 0 2SO3(g)的△H 0
(填“>”或“<”):若在恒温、恒压条件下向上述平衡体系中通入氦气,平衡 移动(填“向左”“向右”或“不”)
②若温度为T1、T2,反应的平衡常数分别为K1,K2,则K1 K2;反应进行到状态D时, 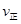  (填“>”“<”或“=”) (填“>”“<”或“=”)
(2)氮是地球上含量丰富的一种元素,氮及其化合物在工农 业生产、生活中有着重要作用,
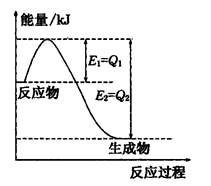
①如图是一定的温度和压强下N2和H2反应生成lmolNH3过程中能量变化示意图,请写出工业合成氨的热化学方程式:
(△H的数值用含字母Q1、Q2的代数式表示)
②氨气溶于水得到氨水,在25℃下,将a mol·L-1的氨水与b mol·L-1的盐酸等体积混合,反应后溶液显中性,则c(NH4+) c(Cl-)(填“>”、“<”或“=”);用含a和b的代数式表示出该混合溶液中氨水的电离平衡常数 .
(3)海水中含有大量的元素,常量元素如氯,微量元素如碘,其在海水中均以化合态存在,在25℃下,向0.1L0.002mol·L-l的NaCl溶液中逐滴加入适量的0.1L0.002mol·L-l硝酸银溶液,有白色沉淀生成,从沉淀溶解平衡的角度解释产生沉淀的原因是 ,向反应后的浊液中继续加入0.1L0.002mol·L-1的NaI溶液,看到的现象是 ,产生该现象的原因是(用离子方程式表示) 。
(已知:25℃时KSP(AgCl)=1.6×l0-10 KSP(AgI)=1.5×l0-16)
参考答案:(1)①< 向左 (2分)
②> > (2分)
(2)①N2(g)+3H2(g) 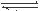 2NH3(g)△H=2(Q1-Q2)KJ/mol (3分) 2NH3(g)△H=2(Q1-Q2)KJ/mol (3分)
②= (1分)  (1分) (1分)
(3)C(Ag+)·C(Cl-)>KSP(AgCl) (1分) 白色沉淀变成黄色(1分)
AgCl(s)+I-(aq)=AgI(s)+Cl-(ag) (2分)
本题解析:(1))①由图可知,温度越高,混合体系中SO3的百分含量越小,说明升高温度平衡向逆反应进行,即向左移动,升高温度向吸热反应方向移动,即该反应正反应为放热反应;恒温、恒压条件下向上述平衡体系中通入氦气,体积应增大,反应混合物各组分的浓度降低,等效为降低压强,压强降低平衡向体积增大方向移动,即向左移动.
②温度升高,平衡向吸热方向移动,即向逆反应移动,K值减小,K1>K2,D状态未达平衡,混合体系中SO3的百分含量小于平衡时的,反应向正反应进行,所以V正>V逆,
(2)①由图可知,N2和H2反应生成1molNH3放出的热量为(Q1-Q2)kJ,该反应的热化学反应方程式为N2(g)+3H2(g) 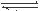 2NH3(g) △H=2(Q1-Q2)KJ/mol , 2NH3(g) △H=2(Q1-Q2)KJ/mol ,
②amol·L-1氨水溶液和bmol·L-1盐酸溶液等体积混合后反应生成氯化铵溶液,溶液中存在电荷守恒,c(NH4+)+c(H+)=c(Cl-)+c(OH-),溶液呈中性c(H+)=c(OH-),所以c(NH4+)=c(Cl
本题难度:困难
|