微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (14分)X、Y、Z、Q、R是五种短周期元素,原子序数依次增大。X、Y两元素最高正价与最低负价之和均为0;Q与X同主族;Z、R分别是地壳中含量最高的非金属元素和金属元素。请回答下列问题:
(1)五种元素原子半径由大到小的顺序是(写元素符号)?
(2)X与Y能形成多种化合物,其中既含极性键又含非极性键,且相对分子质量最小的物质(写分子式)?
(3)由以上某些元素组成的化合物A、B、C、D有如下转化关系
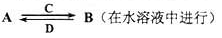
其中C是溶于水显酸性的气体;D是淡黄色固体。
写出C的结构式?;D的电子式??。
①如果A、B均由三种元素组成,B为两性化合物,且不溶于水,则由A转化为B的离子方程式为?。
②如果A由三种元素组成,B由四种元素组成,A、B溶液均显碱性。用离子方程式表示A溶液显碱性的原因?。
A、B浓度均为0.1mol/L等体积的混合溶液中,离子浓度由大到小的顺序为?。
参考答案:(1)Na>Al>C>O>H? (2)C2H2?(3) 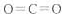
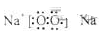
①AlO2-+2H2O+CO2=Al(OH)3↓+HCO3-?或2 AlO2-+3 H2O+CO2="2" Al(OH) 3 ↓+CO32-
②CO32-+H2O HCO3-+OH-,? c(Na+)> c(HCO3-)> c(CO32-)> c(OH-) >c(H+)
HCO3-+OH-,? c(Na+)> c(HCO3-)> c(CO32-)> c(OH-) >c(H+)
本题解析:X、Y、Z、Q、R是五种短周期元素,原子序数依次增大, Z、R分别是地壳中含量最高的非金属元素和金属元素,则Z为氧元素、R为Al元素;X、Y两元素最高正价与最低负价之和均为0,且Q与X同主族,因为最高正价与最低负价之和为0的元素可能为H、C、Si,所以X为氢元素,Q为Na元素,Y为碳元素。
(1)同周期自左而右原子半径逐渐减小,电子层越多,原子半径越大,故原子半径由大到小的顺序为:Na>Al>C>O>H。
(2)H与C形成多种化合物,属于烃类物质,其中既含极性键又含非极性键,且相对分子质量最小是C2H2。
(3)C是溶于水显酸性的气体,则C为CO2,D是淡黄色固体,则D为Na2O2,则:
CO2的结构式为O=C=O,Na2O2的电子式为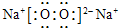 ,
,
①如果A、B均由三种元素组成,B为两性不溶物,结合转化关系可知,A为偏铝酸钠、B为氢氧化铝,偏铝酸根与二氧化碳、水反应生成氢氧化铝与碳酸根或碳酸氢根,反应离子方程式为:AlO2-+2H2O+CO2=Al(OH)3↓+HCO3-?或2 AlO2-+3 H2O+CO2="2" Al(OH) 3 ↓+CO32-
如果A由三种元素组成,B由四种元素组成,A、B溶液均显碱性,结合转化关系可知,A为碳酸钠、B为碳酸氢钠,溶液中碳酸根水解CO32-+H2O HCO3-+OH-, 破坏水的电离平衡,溶液呈碱性;碳酸钠、碳酸氢钠均为0.1mol?L-1的混合溶液中,钠离子浓度最大,碳酸根、碳酸氢根水解,溶液呈碱性,碳酸根的水解程度大于碳酸氢根,故离子浓度由大到小的顺序是c(Na+)> c(HCO3-)> c(CO32-)> c(OH-) >c(H+)。
HCO3-+OH-, 破坏水的电离平衡,溶液呈碱性;碳酸钠、碳酸氢钠均为0.1mol?L-1的混合溶液中,钠离子浓度最大,碳酸根、碳酸氢根水解,溶液呈碱性,碳酸根的水解程度大于碳酸氢根,故离子浓度由大到小的顺序是c(Na+)> c(HCO3-)> c(CO32-)> c(OH-) >c(H+)。
本题难度:困难
2、填空题 在一定条件下,某些化学反应可以用如图框架表示,根据要求回答下列问题:
(1)若A、C、D均为含氯物质,且A的化合价介于C和D之间,D具有漂白性,写出该反应的离子方程式______;
(2)若通过电解的方法获得黄绿色气体C,则该反应的离子方程式为______
(3)若C、D均为气体且均能使澄清石灰水变浑浊,写出符合上述框图要求的化学方程式______
(4)若A为红色金属单质,B为第二周期某种元素的最高价氧化物的水化物的稀溶液,
写出符合上述框图关系的离子方程式______.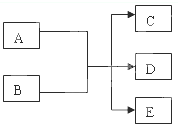
参考答案:(1)若A、C、D均为含氯物质,且A的化合价介于C和D之间,说明发生了氧化还原反应中的歧化反应,所以推断A为Cl2,B为NaOH,D具有漂白性,判断D为次氯酸钠,C为氯化钠,E为水;反应的离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O,故答案为:Cl2+2OH-=Cl-+ClO-+H2O;
(2)通过电解的方法获得黄绿色气体C,判断C为Cl2,反应是电极饱和食盐水的反应,反应的 离子方程式为:2Cl-+2H2O?通电?.?Cl2↑+H2↑+2OH-,
故答案为:2Cl-+2H2O?通电?.?Cl2↑+H2↑+2OH-;
(3)若C、D均为气体且均能使澄清石灰水变浑浊,判断气体为二氧化碳和二氧化硫,符合上述框图要求的化学方程式为碳和浓硫酸加热的反应,反应化学方程式为:
则判断AB为碳和浓硫酸的反应,反应的化学方程式为:C+2H2SO4(浓)?△?.?CO2↑+SO2↑+2H2O,
故答案为:C+2H2SO4(浓)?△?.?CO2↑+SO2↑+2H2O;
(4)A为红色金属单质判断为Cu,B为第二周期某种元素的最高价氧化物的水化物的稀溶液,能和铜反应证明是稀硝酸;铜与稀硝酸的反应离子方程式为:
3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,故答案为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O.
本题解析:
本题难度:简单
3、推断题 通常情况下,微粒A和B为分子,C和E为阳离子,D为阴离子,它们都含有10个电子;B溶于A后所得的物质可电离出C和D;A、B、E三种微粒反应后可得C和一种白色沉淀。请回答:
(1)用化学符号表示下列4种微粒:A________;B_________;C_________;D_________。
(2)写出A、B、E三种微粒反应的离子方程式:___________________________________________。
参考答案:(1)H2O;NH3;NH4+;OH-
(2)Mg2++2NH3+2H2O==Mg(OH)2↓+2NH4+(或Al3++3NH3+3H2O==Al(OH)3↓+3NH4+)
本题解析:
本题难度:一般
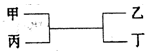
4、选择题 甲、乙为短周期同一主族元素组成的单质,丙、丁为氧化物,它们存在如下转化关系,则满足条件的甲和乙分别为(?)
 ?
?
A.铝和铁
B.碳和硅
C.镁和碳
D.氢气和钠
参考答案:B
本题解析:
正确答案:B
A、铁是副族元素;B、正确,2C+SiO2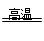 Si+2CO;C、不正确,镁和碳不是同一主族元素;D、2Na+2H2O=2NaOH+H2↑NaOH不是氧化物。
Si+2CO;C、不正确,镁和碳不是同一主族元素;D、2Na+2H2O=2NaOH+H2↑NaOH不是氧化物。
本题难度:一般
5、推断题 A和B是两种盐,其焰色反应皆为紫色(透过蓝色钴玻璃观察).有关实验及现象如下:
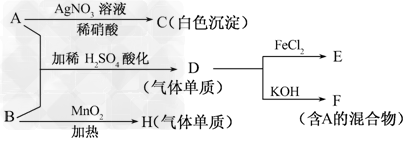
请回答:
(1)写出A、B的化学式________、________.
(2)写出D与FeCl2溶液反应的化学方程式__________________________.
(3)写出A、B反应生成D的离子方程式__________________________________.
(4)H的一种同素异形体的化学式为________.
参考答案:(1)KCl;KClO3
(2)2FeCl2+Cl2===2FeCl3
(3)5Cl-+ClO3-+6H+===3Cl2↑+3H2O
(4)O3
本题解析:
本题难度:一般