微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列分子含有的电子数目与HF相同,且只有两个极性共价键的是
[? ]
A.CO2
B.N2O
C.H2O
D.CH4
参考答案:C
本题解析:
本题难度:简单
2、填空题
结构图中“●”代表原子序数从1到10的元素的原子实(原子实是原子除去最外层电子后剩余的部分),小 黑点代表未用于形成共价键的最外层电子,短线代表化学键。(示例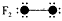 )
)
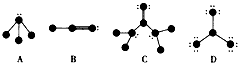
根据图中各图表示的结构特点,写出该分子的化学式:A___;B___;C___;D___。
参考答案:NH3;HCN;CO(NH2)2;BF3
本题解析:
本题难度:一般
3、选择题 下列物质中,只含非极性共价键的是( )
A.I2
B.MgCl2
C.HCl
D.NaOH
参考答案:A、碘单质是由一种元素组成的,含有的共价键只有非极性共价键,故A正确;
B、氯化镁属于离子化合物,含有离子键,不含共价键,故B错误;
C、氯化氢属于共价化合物,共价键是不同元素形成的,所以极性共价键,故C错误;
D、氢氧化钠属于离子化合物,含有离子键和极性共价键,故D错误;
故选A.
本题解析:
本题难度:一般
4、填空题 根据所学知识,回答以下问题:
(1)Ni(CO)4是无色液体,沸点42.1℃,熔点-19.3℃,难溶于水,易溶于有机溶剂推测Ni(CO)4是____________分子(填“极性”或“非极性”)。
(2)肼(N2H4)分子可视为NH3分子中的一个氢原子被-NH2(氨基)取代形成的另一种氮的氢化物。
①N2H4的结构式为?;NH4+的空间构型是?。
②肼可用作火箭燃料,燃烧时发生的反应是:N2O4(l)+2N2H4(l)===3N2(g)+4H2O(g) △H=-1038.7 kJ·mol-1若该反应中有259.7kJ能量释放时,则形成的π键有______mol。
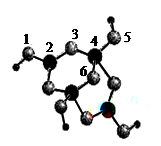
(3)硼砂 是含结晶水的四硼酸钠,其阴离子Xm-(含B、O、H三种元素)的球棍模型如图所示:则Xm-的化学式为?,硼原子轨道的杂化类型有?杂化,原子3的轨道杂化类型为?杂化,Na+与Xm-之间的作用力是?。
(4)BN晶体,具有熔沸点高,耐磨擦和较高的硬度等性质。则BN的晶体类型是?,N的价层电子的电子排布图为?。
参考答案:(1)非极性(1分) (2)①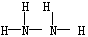 (2分)? 正四面体 (1分)② 1.5mol(2分)
(2分)? 正四面体 (1分)② 1.5mol(2分)
(3)[B4O5(OH)4]2-(2分),Sp2和Sp3,Sp3(3分),离子键(1分)
(4)原子晶体(1分),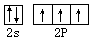 (2分)。
(2分)。
本题解析:(1)Ni(CO)4是无色液体,沸点42.1℃,熔点-19.3℃,难溶于水,易溶于有机溶剂,这些性质说明该化合物应该是分子晶体。根据相似相溶原理可知,Ni(CO)4是非极性分子。
(2)①肼(N2H4)分子可视为NH3分子中的一个氢原子被-NH2(氨基)取代形成的另一种氮的氢化物,则根据氨气的金刚石可知,N2H4的结构式为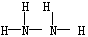 。由于在NH4+中氮原子的4个价电子全部参与成键,不存在孤对电子,所以NH4+的空间构型是正四面体结构。
。由于在NH4+中氮原子的4个价电子全部参与成键,不存在孤对电子,所以NH4+的空间构型是正四面体结构。
②根据热化学方程式可知,如果该反应中有259.7kJ能量释放时,则参加反应的肼的物质的量是259.7kJ÷1038.7 kJ/mol=0.25mol,则生成0.75mol氮气。又因为三键是由2个π键和1个α键构成的,则形成的π键有0.75mol×2=1.5mol。
(3)①1,3,5,6代表氧原子,2,4代表B原子。3号氧原子形成2个单键,所以氧原子是sp3杂化。2号B形成3个键,则B原子为sp2杂化,4号B形成4个键,则B原子为sp3杂化;?B一般是形成3个键,4号B形成4个键,其中1个键很可能就是配位键,配位键存在4号与5号之间。观察模型可知Xm-是(H4B4O9)m-,依据化合价H为+1,B为+3,O为-2,可得m=2,则化学式为[B4O5(OH)4]2-。该微粒和钠离子形成的应该是离子键。
(4)BN晶体,具有熔沸点高,耐磨擦和较高的硬度等性质,这些性质说明,BN的晶体类型是原子晶体,根据构造原理、泡利原理和洪特规则可知,N的价层电子的电子排布图为 。
。
点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强,侧重对学生能力的培养和解题方法的指导与训练,旨在考查学生灵活运用基础知识解决实际问题的能力,有利于培养学生的应试能力和逻辑推理能力。该题以“周期表中元素的推断”为载体,比较全面考查学生有关元素推断知识和灵活运用知识的能力。考查学生对元素周期表的熟悉程度及其对表中各元素性质和相应原子结构的周期性递变规律的认识和掌握程度。考查了学生对物质结构与性质关系以及运用元素周期律解决具体化学问题的能力。
本题难度:一般
5、选择题 X、Y为短周期元素,X位于I A族,X与Y可形成化合物X2Y,下列说法正确的是
[? ]
A.X的原子半径一定大于Y的原子半径
B.X与Y的简单离子不可能具有相同的电子层结构
C.两元素形成的化合物中,原子个数比不可能为1:1
D.X2Y可能是离子化合物,也可能是共价化合物
参考答案:D
本题解析:
本题难度:简单