微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (16分)A、B、C、D都是中学化学中的常见物质,其中A、B、C均含有同一种元素,在一定条件下相互转化关系如下(部分反应中的水已略去)。
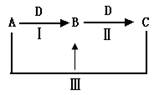
(1)若A是一种强碱,C为厨房中的用品。
①反应Ⅲ的离子方程式是__________________________________。
②下列有关B、C的说法正确的是?
A.向B的饱和溶液中通入D,将有晶体析出
B.可以用BaCl2或CaCl2稀溶液或Ba(OH)2稀溶液鉴别B、C两种溶液
C.分别取等质量的B、C两种固体与足量盐酸反应C产生气体多
D.取a克B、C的混合物充分加热,固体质量减重b克,由此可计算出混合物中B的质量分数
E.取a克B、C的混合物与足量稀硫酸充分反应,逸出的气体用碱石灰完全吸收,增重b克, 由此可计算出混合物中B的质量分数
(2)若A、D均为单质,且A为气体,D元素的一种红棕色氧化物常用作颜料。
①反应Ⅲ的离子方程式是__________________________________。
②向沸水中逐滴加入5~6滴B的饱和溶液,继续煮沸至溶液呈红褐色,该反应的化学方程式为:?。区分该分散系与其它分散系最本质的特征是?。
⑶若常温下A、C是气体,B是固体。
①反应Ⅲ的化学方程式是__________________________________.
有两瓶经过C气体和(2)中的A气体漂白的品红溶液,如何通过简单实验进行鉴别??
?
?。
③在BaCl2溶液中通入C气体,未见沉淀生成,若先通入下列的另一种气体,再通入C;或者向通入C气体的BaCl2溶液中加入下列物质,可以看到沉淀的有_______(填序号)。
A、Cl2? B、NH3? C、HCl? D、CO2?E、KNO3?
参考答案:(16分,每空2分)(1)①HCO3-+OH-="==" H2O+CO32-?②ACD
(2)①Cl2+2Fe2+===2Cl-+2Fe3+? ②FeCl3+3H2O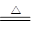 ?Fe(OH)3(胶体)+3HCl
?Fe(OH)3(胶体)+3HCl
分散质微粒直径在1~100 nm之间。
(3)①SO2+2H2S===3S↓+2H2O
②分别取少量经漂白的品红溶液于试管中,加热,恢复红色的是经过C气体漂白的品红溶液,不能恢复红色的是经过(2)中的A气体漂白的品红溶液
③ABE
18、
本题解析:本题为开放性试题,由转化关系,我们很容易想到,①连续氧化、②碱、正盐、酸式盐等。(1)A为强碱,为NaOH、Na2CO3、NaHCO3;(2)D红棕色颜料为Fe2O3,故A:Cl2、D:Fe;(3)C气体漂泊品红,并与Cl2的原理不一样,为SO2,改组为连续氧化得到:H2S→S→SO2。
本题难度:一般
2、填空题 已知A是盐类物质(正盐),从A的水溶液出发有下图所示的一系列变化:

试回答:
(1)物质的化学式:A______,C______,D______
(2)写出A→D的离子方程式______
(3)写出E→F的离子方程式______
(4)鉴定物质F的方法______.
参考答案:(1)由C+氨水→A,D+C的溶液→A,知D为NH3,则A为铵盐,由A可跟酸反应,又可与碱反应且A为正盐且为弱酸弱碱盐,A与浓硫酸反应生成B是(NH4)2SO4,推知F为K2SO4,E为K2SO3,C为SO2,即A为(NH4)2SO3,B为(NH4)2SO4,C为SO2,D为NH3,E为K2SO3,F为K2SO4,故答案为:(NH4)2SO3;SO2;NH3;
(2)A→D为(NH4)2SO3? 和KOH的反应,反应的离子方程式为NH4++OH-?△?.?NH3↑+H2O,
故答案为:NH4++OH-?△?.?NH3↑+H2O;
(3)SO32-具有还原性,与具有氧化性的Br2发生氧化还原反应生成SO42-和Br-,
反应的离子方程式为SO32-+Br2+H2O=SO42-+2Br-+2H+,
故答案为:SO32-+Br2+H2O=SO42-+2Br-+2H+;
(4)可分别检验K+和SO42-,可用焰色反应鉴定K+,隔蓝色钴玻璃,火焰呈紫色,用BaCl2检验SO42-,具体做法为通过焰色反应鉴定K+(隔蓝色钴玻璃,火焰呈紫色);取少量F的溶液加入BaCl2和盐酸的溶液,若产生白色沉淀,证明SO42-的存在,
故答案为:通过焰色反应鉴定K+(隔蓝色钴玻璃,火焰呈紫色);取少量F的溶液加入BaCl2和盐酸的溶液,若产生白色沉淀,证明SO42-的存在.
本题解析:
本题难度:简单
3、填空题 A、B、C、X均为中学化学常见的纯净物,它们之间有如下转化关系(副产物已略去)。
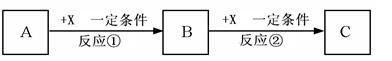
试回答:
(1)若X是强氧化性单质,则A不可能是?(填字母)。
a.S? b.N2? c.Na? d.Mg? e.Al
(2)若X是金属单质,向C的水溶液中滴加AgNO3溶液,产生不溶于稀HNO3的白色沉淀,则B的化学式为?;在贮存C溶液时应加入少量X,理由是?(用必要的文字和离子方程式表示)。
(3)若A、B、C为含有金属元素的无机化合物,X为强酸或强碱,A溶液与C溶液反应生成B。反应①的离子方程式可能为?或?。
参考答案:(1)de(2分,选对1个得1分,有错不得分)
(2)FeCl3(1分)2Fe3++Fe=3Fe2+,防止Fe2+被氧化(2分)
(3)Al3++3OH-=Al(OH)3↓(2分)[Al(OH)4]-+H+=Al(OH)3↓+H2O(2分)
本题解析:(1)若X是氧气时,A分别是a.Sb.N2c.Na?都能满足,故选de。(2)若X是金属单质,A可以为铁,B为氯化铁,C为氯化亚铁。由于亚铁离子易被空气氧化所以加入铁粉发生反应为2Fe3++Fe=3Fe2+,这样可以防止Fe2+被氧化。(3)根据题干信息,A溶液与C溶液反应生成B。可知两者分别是铝离子和偏铝酸根离子的盐溶液,故发生的离子反应为Al3++3OH-=Al(OH)3↓和[Al(OH)4]-+H+=Al(OH)3↓+H2O。
本题难度:一般
4、填空题 (10分)现有aA、bB、cC、dD、eE五种短周期元素,它们都是生命体不可缺少的重要元素。已知它们的原子序数有如下关系:a+b=c,a+c=d,c+d=e,B、D、E都有多种同素异形体。B的化合物种类与A的化合物种类何者更多,目前学术界还有争议,但有一点是肯定的,那就是没有第三种元素的化合物种数会超出它们。根据以上信息回答下列有关问题:
(1)写出C2A4的电子式?。C2A4和A2D2既具有氧化性,又具有还原性,从化合价的角度解释C2A4和A2D2既具有氧化性又具有还原性的原因?
?。
(2)A和B可以形成很多种化合物,用电子式表示A和B形成的最简单化合物的形成过程:
? ?,该化合物与CA3和A2D的熔点由高到低的顺序为?(用化学式表示)。
?,该化合物与CA3和A2D的熔点由高到低的顺序为?(用化学式表示)。
(3)燃料电池是一种新型电池。由一种日常生活中最常见的有机物(分子式为B2A6D)与D的单质以KOH溶液为电解质组成电池,引起了人们的普遍重视。写出负极的电极反应式:?。
(4)E的同素异形体中有一种通常情况下不稳定,在空气中极易自燃。CA3、A2D、EA3的热稳定性由强到弱的顺序为?(用化学式表示)。
参考答案:(共10分)
(1)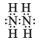 (1分)? N2H4中N显-2,H2O2中O显-1,均为相应元素的中间价态,所以既有氧化性,又有还原性(2分)
(1分)? N2H4中N显-2,H2O2中O显-1,均为相应元素的中间价态,所以既有氧化性,又有还原性(2分)
(2)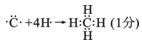 ? H2O>NH3>CH4(2分)
? H2O>NH3>CH4(2分)
(3)CH3CH2OH-12e-+16OH- 2CO32-+11H2O (2分)
2CO32-+11H2O (2分)
(4)H2O>NH3>PH3 (2分)
本题解析:略
本题难度:一般
5、填空题 (共8分)现有A、B、C、D、E、F六种物质,它们的相互转化关系如下图所示。已知A和B是单质,B、E、F在常温下为气体,C为淡黄色固体。

(1)写出A、B的化学式:A?,B?
(2)写出A生成C的化学方程式?
(3)写出C与D反应生成E的化学方程式?
参考答案::(1)Na、H2?
(2)2Na + O2 = Na2O2
(3)2Na2O2 + 2H2O =" 4NaOH" + O2↑
本题解析:C为淡黄色固体且由A点燃生成应为过氧化钠,A为钠,F为气体且与过氧化钠反应生成气体E,所以F为二氧化碳,E为氧气, B为氢气,D为水。
点评:熟悉钠和钠的化合物的性质和特征。
本题难度:一般