微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 A~G各物质间的关系如图,其中B、D为气态单质。
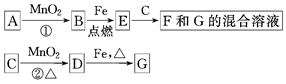
请回答下列问题。
(1)物质C和E的名称分别为?、?;
(2)可选用不同的A进行反应①,若能在常温下进行,其化学方程式为?;若只能在加热情况下进行,则反应物A应为?;
(3)MnO2在反应①和反应②中的作用分别是?、?;
(4)新配制的F溶液应加入?以防止其转化为G。检验G溶液中阳离子的常用试剂是?,实验现象为?。
参考答案:(1)浓盐酸 四氧化三铁
(2)2H2O2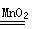 2H2O+O2↑ KClO3
2H2O+O2↑ KClO3
(3)催化剂 氧化剂
(4)铁屑 KSCN溶液 溶液呈红色
本题解析:解答本题注意以下两点:
(1)MnO2常用作催化剂和制Cl2的氧化剂。
(2)Fe为变价金属,Fe2+易被氧化。
本题难度:一般
2、推断题 A~J分别表示中学化学中常见的一种物质,它们之间相互关系如下图所示(部分反应物、生成物没有列出),且已知G为主族元素的固态氧化物,A、B、C、D、E、F六种物质中均含同一种元素。请填写下列空白
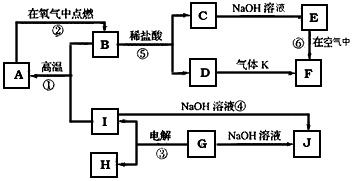
(1)A、B、C、D、E、F六种物质中的含有同一种元素在周期表中位置_________________,
(2)写出检验D溶液中阳离子的方法___________________。
(3)写出反应④的离子方程式_______________________。
(4)若28gA单质在足量的氧气中灼烧,反应放出的热量为QkJ(Q>0),写出这个反应的热化学方程式:___________________________;
(5)若向气体K的水溶液中加入盐酸,使其恰好完全反应,所得溶液的pH________7 (填“>”、“<”或“=”),用离子方程式表示其原因:___________________;若向气体K的0.1mol/L水溶液中加入pH=1的硫酸,且氨水与硫酸的体积比为1:1,则所得溶液中含各离子物质的质量浓度由大到小的关系是_______________________。
参考答案:(1)第四周期、第Ⅷ族
(2)取少许D溶液于试管中,滴加KSCN溶液,溶液变红色,证明D溶液中含有Fe3+(答案合理即可)
(3)2Al+2OH-+2H2O==2AlO2-+3H2↑?
(4)3Fe(s)+2O2(g)==Fe3O4(s) △H=-6QkJ/mol?
(5)<;NH4++H2O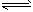 NH3·H2O+H+;c(NH4+>c(SO42-)>c(H+)>c(OH-)
NH3·H2O+H+;c(NH4+>c(SO42-)>c(H+)>c(OH-)
本题解析:
本题难度:困难
3、填空题 (12分)A、B、C、D都是短周期元素,原子半径D>C>A>B,其中A、B处在同一周期,A、C处在同一主族。C原子核内质子数等于A和B的原子核内质子数之和,C原子最外层上的电子数是D原子最外层电子数的4倍。试根据以上叙述回答:
(1)写出这四种元素名称:A_________, B?, C?, D ?。
(2)C元素在周期表中的位置:?
(3)这四种元素中的非金属氢化物的稳定性由大到小的顺序是?。(用化学式表示)
(4)A与B形成的三原子分子的电子式是?,B与D形成的原子个数比为1:1的化合物的电子式是?。
(5)D元素最高价氧化物对应水化物的化学式是?,与常见的两性氢氧化物反应的化学方程式为___________________________________?_____。
参考答案:(12分)(1)A___碳____, B?氧? , C?硅? , D?钠?。
(2)第三周期第ⅣA族?(3)H2O>CH4>SiH4?。
(4)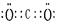 ?,
?,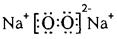 。
。
(5) NaOH ,___NaOH+Al(OH)3=NaAlO2+2H2O__。
本题解析:略
本题难度:一般
4、推断题 A是用途最广的金属,B、C是两种常见气体单质,E溶液为常见强酸,D溶液中滴加KSCN溶液显红色,它们相互转化关系如图所示。?
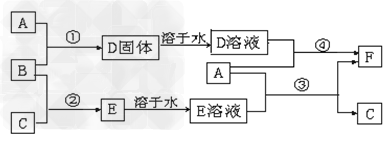
?请回答:
(1)写出B物质的化学式:_________;F的名称:__________。
(2)写出第③步反应的化学方程式为?___________。
(3)第④步反应中溶液颜色的变化____________;
(4)F溶液中滴入NaOH溶液可能产生的实验现象是______________。
参考答案:(1)Cl2?;氯化亚铁
(2)Fe?+2HCl?=?FeCl2?+?H2↑?
(3)溶液由黄色变为浅绿色,2Fe3+ +?Fe?=3Fe2+?
(4)先生成灰白色沉淀,立即变成灰绿色,最后变成红褐色
本题解析:
本题难度:一般
5、简答题 (I)酸雨形成的主要原因是______.
某化学学习小组采集的酸雨样品,每隔一段时间测定一次pH值,得数据如下(提示:pH越小酸性越强)
| 时间 | 开始 | 8h后 | 16h后 | 24h后 | 32h后 | 40h后 | 48h后
pH
5.0
4.8
4.6
4.3
4.2
4.0
4.0
|
酸雨样品pH值变小的主要原因是______,发生的反应为______.
(II)A、B、C、D是中学化学的常见物质,其中A、B、C均含有同一种元素.在一定条件下相互转化的关系如图所示(部分反应中的H2O已略去).请填空:
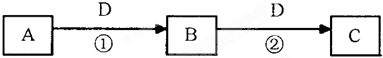
(1)若A可用于自来水消毒,D是生产、生活中用量大、用途广的金属单质,写出用A制漂白粉的化学反应方程式______.
(2)若D与C60互为同素异形体,A与O3互为同素异形体,则C在高炉炼铁中的主要反应方程式为______.
(3)若D是空气质量预报要报的气体,相同条件下密度是氧气的两倍,A是烧碱溶液,则可以验证B是否变质的一组试剂是______(请写出试剂名称).若已部分变质则实验现象为______.
(4)若A为氨气,C为二氧化氮气体,则反应①的化学方程式为______.
参考答案:(I)大量燃烧化石燃料生成二氧化硫等,导致酸雨;酸雨样品中的H2SO3逐渐被氧化成H2SO4,使溶液的酸性增强,反应方程式为:2H2SO3+O2=2H2SO4,
故答案为:大量燃烧化石燃料生成二氧化硫等;酸雨样品中的H2SO3逐渐被氧化成H2SO4,使溶液的酸性增强;2H2SO3+O2=2H2SO4;
(II)A、B、C、D是中学化学的常见物质,其中A、B、C均含有同一种元素,
(1)D是生产、生活中用量大、用途广的金属单质,则D为Fe,A可用于自来水消毒,结合转化关系,可知A为Cl2,B为FeCl3,C为FeCl2,利用氯气与石灰乳反应生成氯化钙、次氯酸钙与水制备漂白粉,反应方程式为:
2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,
故答案为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;
(2)若D与C60互为同素异形体,A与O3互为同素异形体,由转化关系可知,A为氧气、D为碳,故B为二氧化碳、C为CO,在高炉炼铁中CO与氧化铁反应得到Fe与二氧化碳,反应方程式为:Fe2O3+3CO高温.2Fe+3CO2,
故答案为:Fe2O3+3CO高温.2Fe+3CO2;
(3)若D是空气质量预报要报的气体,相同条件下密度是氧气的两倍,则D为SO2,A是烧碱溶液,由转化关系可知,B为Na2SO3,C为NaHSO3,Na2SO3变质会生成Na2SO4,可以用盐酸和氯化钡溶液检验,取少量B配成溶液,加入适量氯化钡溶液有白色沉淀生成,再加过量盐酸沉淀部分溶解并放出有刺激性气味的气体,
故答案为:盐酸和氯化钡溶液;取少量B配成溶液,加入适量氯化钡溶液有白色沉淀生成,再加过量盐酸沉淀部分溶解并放出有刺激性气味的气体;
(4)若A为氨气,C为二氧化氮气体,则反应①为氨气与氧气反应得到NO与水,反应方程式为:4NH3+O2高温.催化剂4NO+6H2O,
故答案为:4NH3+O2高温.催化剂4NO+6H2O.
本题解析:
本题难度:简单