微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 RO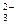 +2R
+2R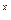 +6H
+6H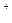
 3R+3H
3R+3H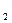 O是某同学作业中的一个离子方程式,其中R
O是某同学作业中的一个离子方程式,其中R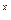 所带电荷模糊不清,若R所带电荷用x表示,则x应是(?)
所带电荷模糊不清,若R所带电荷用x表示,则x应是(?)
A.“+”
B.“2-”
C.“3+”
D.“4-”
参考答案:B
本题解析:离子方程式两边电荷守恒,据此可列式求得x。
本题难度:一般
2、填空题 铁、铝、铜等金属及其化合物在日常生活中应用广泛,请根据下列实验回答问题:
(1)生产中含有一种铁碳化合物X(Fe3C)。X在足量的空气中高温煅烧,生成有磁性的固体Y,将Y溶于过量盐酸后,溶液中含有的大量阳离子是________。
(2)氧化铁是重要的工业颜料,用废铁屑制备它的流程如下所示。
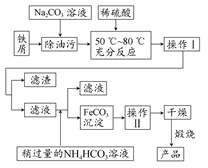
回答下列问题:
①操作Ⅰ所用的分离仪器的名称是________;操作Ⅱ的名称是________,该操作的具体方法是________。
②Na2CO3溶液可以除油污,原因是(用离子方程式表示)________。
③请写出生成FeCO3沉淀的离子方程式:________。
参考答案:(1)Fe2+、Fe3+、H+ (2)①漏斗;洗涤;向漏斗中加入蒸馏水到刚浸没沉淀,让蒸馏水自然流下,重复此操作2~3次 ②CO32-+H2O HCO3-+OH-③Fe2++2HCO3-=FeCO3↓+CO2↑+H2O
HCO3-+OH-③Fe2++2HCO3-=FeCO3↓+CO2↑+H2O
本题解析:(1)Y是Fe3O4,溶解在过量盐酸中后,溶液中大量存在的阳离子是Fe2+、Fe3+、H+。(2)①操作Ⅰ为过滤,分离仪器是漏斗;操作Ⅱ是对沉淀进行洗涤,方法是向漏斗中加适量蒸馏水并让水自然流下,重复2~3次即可。②Na2CO3水解使溶液显碱性,因此具有除油污的作用。③操作Ⅰ后得到的滤液中Fe2+与HCO3-作用得到FeCO3沉淀及H+,H+再与另外一部分HCO3-结合生成CO2与水。
本题难度:一般
3、选择题 下列离子方程式书写正确的是
A.将少量SO2通入漂白粉溶液中:CaSO3↓+2HClO
B.CuSO4溶液与少量Ba(OH)2溶液反应:+Cu(OH)2↓
C.Fe2O3与氢碘酸反应:
D.向双氧水中滴加少量酸性高锰酸钾溶液,溶液的紫红色褪去:
参考答案:B
本题解析:分析:A、次氯酸具有强氧化性,亚硫酸钙被氧化为硫酸钙;
B、硫酸铜和氢氧化钡反应生成硫酸钡沉淀和氢氧化铜沉淀;
C、三价铁离子具有氧化性,氧化碘离子为碘单质;
D、原子不守恒.
解答:A、次氯酸具有强氧化性,亚硫酸钙被氧化为硫酸钙,将少量SO2通入漂白粉溶液中:SO2+H2O+Ca2++3ClO-=CaSO4↓+2HClO+Cl-,故A错误;
B、硫酸铜和氢氧化钡反应生成硫酸钡沉淀和氢氧化铜沉淀,反应的离子方程式为Cu2++2OH-+Ba2++SO42-=BaSO4↓+Cu(OH)2↓,故B正确;
C、Fe2O3具有氧化性,I-具有还原性,二者会发生氧化还原反应,离子方程式为Fe2O3+6H++2I-=2Fe3++I2+3H2O,故C错误;
D、选项中原子不守恒,离子方程式为:20H-+2MnO4-+5H2O2=2Mn2++5O2↑+10H2O,故D错误;
故选B.
点评:本题考查离子方程式正误判断和书写方法,注意氧化性离子和还原性离子的分析,题目难度中等.
本题难度:困难
4、选择题 下列有关离子的说法正确的是
A.H+、NO3-、Fe2+、Na+四种离子在溶液中能够大量共存
B.Cl2通入水中的离子方程式:Cl2+H2O=2H++Cl-+ClO-
C.1mol Na2O2中含有2mol阳离子和1mol阴离子
D.向某溶液中加入澄清石灰水变浑浊,再加入盐酸,变澄清且有无色无味气体产生,则原溶液中一定含有碳酸根离子
参考答案:C
本题解析:A、在酸性条件下NO3-具有强氧化性,能氧化Fe2+,二者不能大量共存,A不正确;B、次氯酸是弱酸,离子方程式中应该有化学式表示,且氯气溶于水与水的反应是可逆反应,B不正确;C、过氧化钠中阴阳离子的个数之比=1:2,所以1mol Na2O2中含有2mol阳离子和1mol阴离子,C正确;D、向某溶液中加入澄清石灰水变浑浊,再加入盐酸,变澄清且有无色无味气体产生,这说明产生的沉淀是碳酸钙,生成的气体是CO2,但CO32-和HCO3-均能与澄清的石灰水反应生成碳酸钙沉淀,所以原溶液中不一定含有碳酸根离子,D不正确,答案选C。
本题难度:一般
5、填空题 某无色溶液X,由Na+、Ag+、Ba2+、Al3+、[Al(OH)4]--、 MnO4—、CO32--?、SO42—中的若干种离子组合,取溶液进行如下连续试验:(填化学用语)
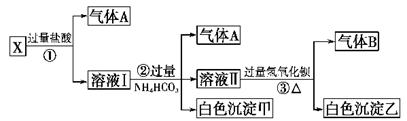
(1)气体A的成分是:_________________,气体B的成分是_____________
(2)X溶液中一定存在的离子是:____________________________
(3)写出步骤①发生反应的所有离子反应方程式:_________________________
(4)写出步骤②形成白色沉淀甲的离子方程式:______________________
(5)写出白色沉淀乙的可能组成:____________________________
参考答案:(1)CO2? NH3?(2)CO32-、 AlO2-?、 Na+
(3)CO32-+2H+=H2O+CO2↑? [Al(OH)4]-+4H+=Al3++4H2O
(4)Al3++3HCO3-=Al(OH)3↓+3CO2↑ ;(5)一定存在BaCO3,可能有BaSO4
本题解析:(1)无色溶液中不可能含有紫色的MnO4—;向X中加入HCl,产生气体A是CO2,则说明原来的溶液中含有CO32--,由于CO32—与Ba2+、Ag+会发生离子反应而不能电离共存,而没有产生沉淀,说明不含Ag+、Ba2+;CO32—与Al3+会发生双水解反应液不能大量共存,因此也不含有Al3+;向溶液I中加入过量的NH4HCO3溶液,既有气体产生,何有白色沉淀产生,说明发生了双水解反应,则原溶液中含有[Al(OH)4]-(或AlO2-),产生的沉淀是Al(OH)3,气体是CO2;再向溶液中加入过量的Ba(OH)2溶液,产生气体B是氨气,由于②中加入了过量的NH4HCO3溶液,所以白色沉淀乙一定含有BaCO3;若原溶液中含有SO42—,则沉淀中还会含有BaSO4。由于溶液呈电中性,含有的CO32-和 AlO2-都是阴离子,而阳离子Ag+、Ba2+、Al3+都不存在,所以一定还含有Na+;(1)气体A的成分是CO2;气体B的成分是NH3;(2)根据上述分析可知在X溶液中一定存在的离子是:CO32-、 AlO2-、Na+;一定不含的离子是Ag+、Ba2+、Al3+、MnO4—;可能含有的离子是SO42—。(3)步骤①发生反应的所有离子反应方程式是CO32-+2H+=H2O+CO2↑;[Al(OH)4]-+4H+=Al3++4H2O;(4)写出步骤②形成白色沉淀甲的离子方程式是Al3++3HCO3-=Al(OH)3↓+3CO2↑;(5)白色沉淀乙中一定存在BaCO3,可能有BaSO4。
本题难度:一般