微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列叙述中,不正确的是
[? ]
A.原电池是将化学能转化为电能的装置
B.轮船底部镶嵌锌块,锌作负极,以防船体被腐蚀
C.钢铁腐蚀的负极反应:Fe-3e-=?Fe3+
D.电镀时,镀层金属作阳极,镀件作阴极
参考答案:C
本题解析:
本题难度:简单
2、简答题 如图所示装置中,甲、乙两个烧杯分别依次盛放200mL饱和食盐水、足量的AgNO3溶液,a、b、c、d四个电极均为石墨电极.接通电源,经过一段时间后,测得乙中d电极质量增加了2.16g.据此回答问题:
(1)电源的N端为______极;
(2)电极b上发生的电极反应为______;
(3)电极c上生成的气体在标准状态下的体积:______;
(4)甲溶液的pH为______(设溶液体积仍为200mL);
(5)欲在丙烧杯中实现铁的表面镀上一层锌,则电解质溶液为______,e电极的材料是:______,f电极的电极反应式为______.

参考答案:(1)测得乙中d电极质量增加了2.16g,则d电极发生Ag++e-=Ag,所以d电极为阴极,N为电源的负极,故答案为:负;
(2)电解食盐水,b为阴极,发生2H++2e?=H2↑,故答案为:2H++2e?=H2↑;
(3)d电极发生Ag++e-=Ag,c,发生4OH--4e-=2H2O+O2↑,由电子守恒可知4Ag~O2↑,则气体的体积为2.16g108g/mol×14×22.4L/mol=0.112L,故答案为:0.112L;
(4)由电子守恒可知2NaOH~2e-~2Ag,n(NaOH)=n(Ag)=0.02mol,则c(NaOH)=0.02mol0.2L=0.1mol/L,所以pH=13,故答案为:13;
(5)丙烧杯中实现铁的表面镀上一层锌,则电解质溶液为ZnCl2,e为Zn,f电极为阴极,其电极反应式为Zn2++2e-=Zn,故答案为:ZnCl2;Zn;Zn2++2e-=Zn.
本题解析:
本题难度:一般
3、填空题 按要求完成下列问题:
(1)在25℃、101kPa下,1g甲醇(液体,分子式为CH3OH)燃烧生成CO2和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为____________________;将该反应设计成碱性燃料电池,写出该电池的负极电极反应方程式 。
(2)氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点。
已知: CH4(g)+H2O(g)=CO(g)+3H2(g) △H=+206.2kJ·mol-1
CH4(g)+CO2(g)=2CO(g)+2H2(g) △H=-247.4 kJ·mol-1
以甲烷为原料制取氢气是工业上常用的制氢方法。CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为 。
(3)已知白磷、红磷燃烧的热化学方程式分别为
P4(s,白磷)+ 5O2=P4O10(s);ΔH=
参考答案:
本题解析:
本题难度:困难
4、选择题 下图各装置中,不能构成原电池的是 (?)?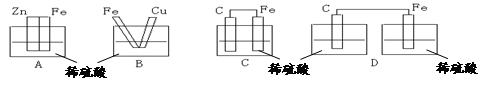
参考答案:D
本题解析:构成原电池的条件是活泼性不同的金属或金属与非金属,导线相连后插入到电解质溶液中,据此可知选项ABC都能构成原电池。D中没有构成完整的闭合回路,不能形成原电池,答案选D。
点评:该题是高考中的常见题型,属于基础性试题的考查。只要是考查学生对原电池形成条件的熟悉掌握程度,以及灵活运用知识逻辑推理能力,也有助于提高学生的应试能力和学习效率。
本题难度:简单
5、填空题 (12分)高氯酸钾广泛用于火箭及热电池业。实验室制取高氯酸钾的步骤为:称取一定质量的KCl、NaClO4溶解,然后混合,经冷却、过滤、滤出晶体用蒸馏水多次洗涤及真空干燥得到。
有关物质溶解度与温度的关系如下表:
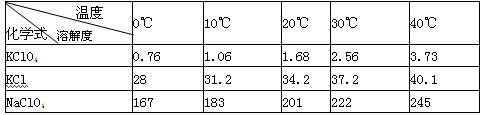
(1)写出实验室制取高氯酸钾的化学方程式: ;用蒸馏水多次洗涤晶体的目的是: 。
(2)Fe和KClO4反应放出的热量能为熔融盐电池提供550-660℃的温度,使低熔点盐熔化导电,从而激活电池,这类电池称为热电池。Li/FeS2热电池工作时,Li转变为硫化锂,FeS2转变为铁,该电池工作时,电池总反应为: 。
(3)Fe和KClO4作为热电池加热材料的供热原理为:KClO4 (s)+4Fe(s)=" KCl" (s)+ 4FeO(s),△H< 0。
①600℃时FeO可部分分解生成Fe3O4,写成有关的化学方程式: 。
②称取一定质量上述加热材料反应后的混合物(假定只含氯化钾一种钾盐)于烧杯中,用蒸馏水充分洗涤、过滤、干燥,固体质量减少了0.43g,在固体中继续加入过量的稀硫酸,微热让其充分反应,固体完全溶解得到的溶液中加入过量的NaOH溶液,经过滤、洗净、干燥,再在空气中充分灼烧得6.0 g棕色固体。求该加热材料反应前,铁和高氯酸钾的质量。(写出计算过程,结果保留2位有效数字) 。
参考答案:(12分)
(1)NaClO4+ KCl= KClO4↓+NaCl (2分)
尽可能除去溶解度较大的杂质 (2分)
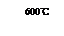 (2)FeS2 +4Li="Fe" +2Li2S (2分)
(2)FeS2 +4Li="Fe" +2Li2S (2分)
(3)①4FeO====Fe3O4+Fe (2分)
②m(Fe)=n(Fe)×56g·mol-1= 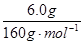 ×2×56g·mol-1=4.2g (2分)
×2×56g·mol-1=4.2g (2分)
m(KClO4)=n(KClO4)×138.5g·mol-1=n(KCl)×138.5g·mol-1=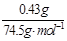 ×138.5g·mol-=0.80g (2分)
×138.5g·mol-=0.80g (2分)
本题解析:(1)KCl、NaClO4溶解,因为KClO4的溶解度较小,所以KClO4以沉淀析出,所以反应的化学方程式为NaClO4+ KCl= KClO4↓+NaCl;因为KCl、NaClO4的溶解度较大,用蒸馏水多次洗涤晶体的目的是尽可能除去溶解度较大的杂质;
(2)Li/FeS2热电池工作时,Li转变为硫化锂,FeS2转变为铁,所以总反应是FeS2 +4Li="Fe" +2Li2S;
 (3)①600℃时FeO可部分分解生成Fe3O4,Fe元素的化合价升高,同时Fe元素的化合价降低,生成Fe单质,则FeO分解的化学方程式为4FeO====Fe3O4+Fe;
(3)①600℃时FeO可部分分解生成Fe3O4,Fe元素的化合价升高,同时Fe元素的化合价降低,生成Fe单质,则FeO分解的化学方程式为4FeO====Fe3O4+Fe;
②根据题意,反应后的混合物为氧化亚铜和氯化钾,用蒸馏水充分洗涤、过滤、干燥,固体质量减少了0.43g,说明KCl的质量是0.43g;在固体中继续加入过量的稀硫酸,微热让其充分反应,固体完全溶解得到的溶液中加入过量的NaOH溶液,经过滤、洗净、干燥,再在空气中充分灼烧得6.0 g棕色固体,氧化亚铜与硫酸反应生成硫酸亚铁,再与氢氧化钠反应生成氢氧化亚铁,在空气中氢氧化亚铁转化为氢氧化铁,灼烧后生成氧化铁,该红棕色固体是氧化铁,所以m(Fe)=n(Fe)×56g·mol-1= 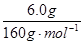 ×2×56g·mol-1=4.2g;m(KClO4)=n(KClO4)×138.5g·mol-1=n(KCl)×138.5g·mol-1=
×2×56g·mol-1=4.2g;m(KClO4)=n(KClO4)×138.5g·mol-1=n(KCl)×138.5g·mol-1=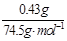 ×138.5g·mol-=0.80g。
×138.5g·mol-=0.80g。
考点:考查对物质制备的分析,化学方程式的书写,物质化学性质的应用,质量计算
本题难度:困难