微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列叙述中,可以说明金属甲比乙活泼性强的是
A.甲和乙用导线连接插入稀盐酸溶液中,乙溶解,甲上有H2气放出
B.在氧化还原反应中,甲比乙失去的电子多
C.将甲乙作电极组成原电池时甲做负极
D.将甲乙作电极组成电解池时甲做正极
参考答案:C
本题解析:A 根据题意可知,甲乙两种金属之间构成原电池,根据甲有有H2气放出,为正极,乙溶解为负极,故乙比甲活泼性强,故A错误;B、在氧化还原反应中,活动性强弱与失去电子的难易有关,与失去电子的多少无关,所以B错误;C在原电池和电解池中,金属性的强弱除与电极本身有关,一般情况,活泼金属为负极,D错,故选C。
点评:本题是高考中的热点问题,一般来说,比较两种金属的金属的活泼性还可以从以下几个方面来考虑:
1.与酸或水反应的剧烈程度,越剧烈越活泼;
2.金属之间的置换。换句话说,(1)就是金属活动性强的从金属活动性弱的盐溶液中将金属活动性弱的金属置换出来。(2)是在金属活动性顺序表中,前者的金属性强于后者。
3.金属对应的最高价氧化物的水化物碱性强弱,碱性越强,金属性越强。
4.金属阳离子的氧化性越强,则单质的还原性越弱,元素的金属性越弱。
本题难度:一般
2、选择题 工业上利用氢气在氯气中燃烧,所得产物再溶于水的方法制得工具书盐酸,流程复杂且造成能量浪费.有人设想利用原电池原理直接制盐酸的同时,获取电能,假设这种想法可行,下列说法肯定错误的是( )
A.两极材料都用石墨,用稀盐酸做电解质溶液
B.通入氢气的电极为原电池的正极
C.电解质溶液中的阳离子向通氯气的电极移动
D.通氯气的电极反应式这Cl2+2e-→2Cl-
参考答案:根据燃料电池的工作原理,利用原电池原理直接制盐酸的方程式为:H2+Cl2=2HCl,该原电池的工作原理和燃料电池的工作原理相似.
A、两极材料可以都用石墨,一极通入氢气,一极通入氯气,可以用稀盐酸做电解质溶液,故A正确;
B、反应H2+Cl2=2HCl中,氢气失电子,所以通入氢气的电极为原电池的负极,故B错误;
C、在原电池中,电解质溶液中的阳离子向正极移动,通氯气的电极为正极,故C正确;
D、通氯气的电极为正极,发生得电子得还原反应,电极反应式为:Cl2+2e-→2Cl-,故D正确.
故选B.
本题解析:
本题难度:简单
3、选择题 右图为番茄电池,下列说法正确的是(? )
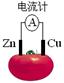
A.一段时间后,锌片质量会变小
B.铜电极附近会出现蓝色
C.电子由铜通过导线流向锌
D.锌电极是该电池的正极
参考答案:A
本题解析:在原电池中较活泼的金属作负极,失去电子,发生氧化反应。电子经导线传递到正极上,所以溶液中的阳离子向正极移动,阴离子向负极移动。正极得到电子,发生还原反应。锌比铜活泼,所以锌是负极,失去电子。铜是正极,溶液中的氢离子得到电子,发生还原反应,因此只有选项A是正确的,答案选A。
本题难度:简单
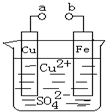
4、简答题 某小组为研究电化学原理,设计如图装置.下列叙述不正确的是( )
A.a和b不连接时,铁片上会有金属铜析出
B.a和b用导线连接时,铜片上发生的反应为:Cu2++2e-=Cu
C.无论a和b是否连接,铁片均会溶解,溶液从蓝色逐渐变成浅绿色
D.a和b用导线连接时,铁片上发生的反应为:Fe-3e-=Fe3+