| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学必备知识点《原电池原理》考点巩固(2017年最新版)(六)
参考答案:C 本题解析:在原电池中,一般情况下较活泼的金属作负极,失去电子,发生氧化反应。所失去的电子经导线传递到正极上,正极得到电子,发生还原反应。A是正极,说明A的活泼性弱于B的,但A不一定排在氢前面,所以选项C是正确的,答案选C。 本题难度:一般 2、选择题 蓄电池在放电时起原电池作用,在充电时起电解池的作用。下式是爱迪生蓄电池分别在充电和放电时的反应: |
参考答案:C
本题解析:A、放电时,化学能转化为电能,正极是NiO2得电子与水结合生成Ni(OH)2,pH增大,正确;B、充电时电能转化为化学能,阴极是Fe(OH)2得电子生成Fe和OH-,正确;C、放电时相当于是原电池装置,阴离子向负极移动,错误;D、该过程中有OH-的消耗和生成,可以将电极浸入某种碱性电解质溶液中,正确,答案选C。
考点:考查蓄电池的反应原理,电极反应式、溶液pH的判断
本题难度:一般
3、填空题 (10分)如图所示:已知甲池的总反应式为:2CH3OH+3O2+4KOH 2K2CO3+6H2O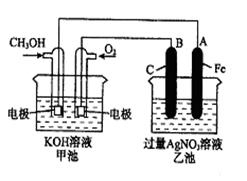
(1)请回答图中甲、乙两池的名称。甲池是 装置,乙池是 装置。
(2)B(石墨)电极的名称是 。在图中标明电子移动的方向。
(3)通入O2的电极的电极反应式是 。
(4)乙池中反应的化学方程式为 。
(5)当乙池中A(Fe)极的质量增加5.40g时,甲池中理论上消耗O2 mL(标准状况下)
参考答案:(14分)(1)原电池(化学能转变成电能) 电解池(电能转变成化学能)(2)阳极
(3)O2+2H2O+4e-=4OH-
(4)4AgNO3+2H2O 4Ag+4HNO3+O2↑ (5)280
4Ag+4HNO3+O2↑ (5)280
本题解析:(1)根据装置可知,甲是原电池,乙是电解池。
(2)原电池中负极失去电子,正极得到电子。所以甲中通入甲醇的是负极,通入氧气的是正极。则B是阳极。电子从原电池的负极经导线传递到电解池的阴极,从电解池的阳极经导线传递到原电池的正极。
(3)氧气得到电子,电极反应式为O2+2H2O+4e-=4OH-。
(4)乙中阴极氢离子放电生成氢气,阳极是银离子放电生成银,所以总反应式为
4AgNO3+2H2O 4Ag+4HNO3+O2↑。
4Ag+4HNO3+O2↑。
(5)铁电极形成的是银,物质的量是5.40g÷108g.mol=0.05mol,转移电子是0.05mol,所以根据电子得失守恒可知,消耗氧气是0.05mol÷4=0.0125mol,标准状况下的体积是0.0125mol×22.4L/mol=0.280L=280ml。
本题难度:一般
4、选择题 在理论上不能用于设计原电池的化学反应是?
[? ]
A、HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l)
B、2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l)
C、2FeCl2+Cl2=2FeCl3
D、3Fe+8HNO3(稀)=3Fe(NO3)2+2NO↑+4H2O
参考答案:A
本题解析:
本题难度:一般
5、填空题 请按要求回答下列问题。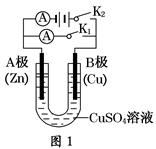
(1)根据图1回答①②:
①若断开K2,闭合K1。
A电极可观察到的现象________________来源:91考试网 91eXAm.org________________________________;
B极的电极反应式为__________________________________________________。
②若断开K1,闭合K2,A电极可观察到的现象是________________;B极的电极反应式为____________。
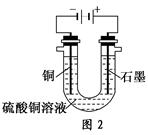
(2)根据图2回答③④:
③将较纯净的CuSO4溶液放入如图所示的装置中进行电解,石墨电极上的电极反应式为________________,电解反应的离子方程式为________________。
④实验完成后,铜电极增重a g,石墨电极产生标准状况下的气体体积________L。
参考答案:(1)①锌不断溶解Cu2++2e-=Cu
②锌极镀上一层红色的铜Cu-2e-=Cu2+
(2)①4OH--4e-=2H2O+O2↑
2Cu2++2H2O 2Cu+O2↑+4H+ ②0.175a
2Cu+O2↑+4H+ ②0.175a
本题解析:(1)①断开K2,闭合K1,则构成原电池。Zn为负极,失去电子变为Zn2+进入溶液;Cu为正极,其电极反应式为Cu2++2e-=Cu。②断开K1,闭合K2,则构成电解池,A极为阴极,有红色铜在Zn极表面析出;B极为阳极,Cu失去电子变成Cu2+进入溶液。
(2)①图2中石墨为阳极,其电极反应式为4OH--4e-=2H2O+O2↑,总电解反应式为
2Cu2++2H2O 2Cu+O2↑+4H+。
2Cu+O2↑+4H+。
②根据转移电子守恒得,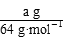 ×2=
×2= ×4
×4
V=0.175a L。
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学试题《原子核外电子的排.. | |