微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 标准状况,体积相同的四支试管中分别盛满Cl2、NH3、SO2和NO2,分别倒立在盛有足量水的水槽中(假设进入试管的液体不扩散),光照充分溶解。
(1)从物质分类的角度可以推测物质的性质。其中SO2属于_______氧化物(填“酸性”、“碱性”或“两性”)。
SO2?+ (? ) → 含氧酸盐。
SO2?+ (? ) → 盐 +? (? )。
(2)装有NO2的试管倒立在盛有足量水的水槽时,反应的化学方程式为___________________。实验现象为______________________________________________________________________。
(3)装有NH3的试管进行实验时,实验完毕试管内溶液的物质的量浓度为?。
(4)装有Cl2的试管倒立在盛有足量水的水槽中经过充分的光照,实验结束试管中剩余的气体是?,生成该气体先后发生的化学方程式有?、?。
参考答案:(1)酸性?碱性氧化物?碱?水
(2)3NO2+H2O=2HNO3+NO?溶液充满试管容积的2/3,气体变为无色
(3)1/22.4 mol/L ?
(4)O2?Cl2+H2O=HCl+HClO? 2HClO 2HCl+O2↑
2HCl+O2↑
本题解析:(1)酸性氧化物是一类能与水作用生成酸或与碱作用生成盐和水或与碱性氧化物反应生成盐的氧化物,故SO2属于酸性氧化物,与碱性氧化物生成含氧酸盐,与碱反应生成盐和水;(2)装有NO2的试管倒立在盛有足量水的水槽时溶液充满试管容积的2/3,气体变为无色,发生的化学方程式为:3NO2+H2O=2HNO3+NO;(3)设试管内NH3的体积为VL,则氨气的物质的量为VL/22.4L/mol,故实验完毕试管内溶液的物质的量浓度为VL/22.4L/mol/VL=1/22.4 mol/L;(4)装有Cl2的试管倒立在盛有足量水的水槽中经过充分的光照后发生如下反应:Cl2+H2O=HCl+HClO,2HClO 2HCl+O2↑,故实验结束试管中剩余的气体是氧气。
2HCl+O2↑,故实验结束试管中剩余的气体是氧气。
本题难度:一般
2、计算题 25 ml 加入到锥形瓶中,再加入过量的KI溶液和过量的H2SO4溶液,静置。待完全反应后,用0.1 mol/L的Na2S2O3溶液作标准溶液滴定反应生成的碘,已知反应式为:
2Na2S2O3 + I2 = Na2S4O6 + 2NaI
反应完成时,共用去Na2S2O3 20.0 ml。则该漂白粉中Ca(ClO)2的质量分数为:?
14、(8分)向盛有KI溶液的试管中加入少许CCl4后滴加氯水,CCl4层变成紫色。如果继续向试管中滴加氯水,振荡,CCl4层会逐渐变浅,最后变成无色。
完成下列填空:
1)写出并配平CCl4层由紫色变成无色的化学反应方程式(如果系数是1,不用填写):

2)整个过程中的还原剂是?。
3)把KI换成KBr,则CCl4层变为_?_色:继续滴加氯水,CCl4层的颜色没有变化。Cl2、HIO3、HBrO3氧化性由强到弱的顺序是?。
4)加碘盐中含碘量为20mg~50mg/kg。制取加碘盐(含KIO3的食盐)1000kg,若用Kl与Cl2反应制KIO3,至少需要消耗Cl2?L(标准状况,保留2位小数)。
参考答案:


本题解析:略
本题难度:一般
3、填空题 (10分)元素氯及其化合物在生产、生活、科研中有广泛的应用。
⑴25℃时,PbCl2固体在不同浓度盐酸(mol·L-1)中的溶解度(mmol·L-1)如图。
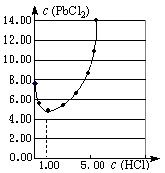
①在制备PbCl2的实验中,洗涤PbCl2固体最好选用?。
a.蒸馏水? b.1mol·L-1盐酸
c.5 mol·L-1盐酸? d.10mol·L-1盐酸
②当盐酸的浓度小于1mol·L-1时,随着盐酸浓度的增大,PbCl2 的溶解度减小,其原因是?。
⑵TCCA广泛用于漂白、杀菌消毒,其学名为三氯均三嗪-2,4,6-三酮,分子式为:C3Cl3N3O3。
①TCCA分子具有完全对称的结构,并含有一个六元环,则其结构简式为?。
②使用TCCA时,需先将该物质溶解于水,其水解产物之一为C3H3N3O3,另一种产
物具有强氧化性,能够杀菌消毒。写出另一种产物的电子式?。
⑶高氯酸铵(AP)作为一种优良的固体推进剂被用于导弹和火箭发射。目前,较为先进的制备方法是电解高纯次氯酸得到高纯高氯酸,再与高纯氨进行喷雾反应制成高氯酸铵。写出由次氯酸电解制备高氯酸的阳极反应式:?。
参考答案:⑴①b? ②Cl-浓度增大,PbCl2的溶解平衡逆向移动
⑵①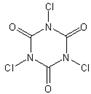 ?②
?②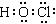
⑶①HClO+3H2O-6e-=ClO4—+7H+
本题解析:略
本题难度:一般
4、选择题 下列说法正确的是
A.在漂白粉中滴入70%的硫酸,立刻产生黄绿色气体,说明硫酸具有还原性
B.粗锌与稀硫酸反应比纯锌快,说明粗锌反应时形成了原电池
C.硬水含有Ca2+、Mg2+、HCO3-、SO42-,煮沸可以完全除去其中的Ca2+、Mg2+
D.pH相同的两种一元酸HA溶液和HB溶液与足量Zn反应,HA比HB反应速率快,说明HA酸性更强
参考答案:B
本题解析:漂白粉中滴入70%的硫酸,立刻产生黄绿色气体次氯酸受热分解产生氯气。硬水煮沸无法完全除去其中的Ca2+、Mg2+,只是将其软化。pH相同的两种一元酸HA溶液和HB溶液与足量Zn反应,HA比HB反应速率快,说明HA酸性更强或者浓度高。
本题难度:简单
5、实验题 (14分)长期存放的亚硫酸钠可能会被空气中的氧气氧化。某化学兴趣小组通过实验来测定亚硫酸钠试剂被氧化的程度,设计了下图实验,请回答下面的问题:
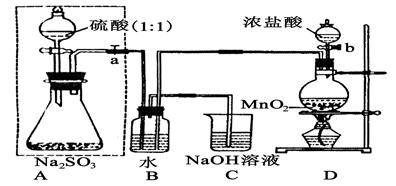
(1)D装置中反应的化学方程式为?。
B装置中反应的离子方程为?。
(2)称量ag Na2SO3样品放入锥形瓶中,向B装置反应后的溶液中加入足量的BaCl2溶液充分反应、过滤、洗涤、干燥,得白色沉淀bg,原样品中Na2SO3的质量分为数为:?。
(3)为保证实验测定的准确性,A中的硫酸什么时候滴加?
C装置中的作用是 _________________。
(4)现有以下试剂:①蒸馏水、②稀盐酸、③稀硝酸、④BaCl2溶液、⑤Ba(NO3)2溶液,请从中选择合适试剂,设计一种不同的实验方法,测定试样中无水亚硫酸钠被氧化的程度,你使用试剂的顺序为:?。(填试剂编号)
参考答案:(1)MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O? Cl2+SO2+2H2O=4H++2Cl-+SO42-
MnCl2+Cl2↑+2H2O? Cl2+SO2+2H2O=4H++2Cl-+SO42-
? (2)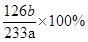 ?
?
(3)待B中水面上方充满了黄绿色的气体?吸收尾气,防止污染大气?
(4)①②④
本题解析:(1)装置D是制氯气的装置,发生的反应为MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O,装置B是氯气氧化SO2的反应,方程式为Cl2+SO2+2H2O=4H++2Cl-+SO42-。
MnCl2+Cl2↑+2H2O,装置B是氯气氧化SO2的反应,方程式为Cl2+SO2+2H2O=4H++2Cl-+SO42-。
(2)得到的bg沉淀是BaSO4,根据Na2SO3—SO2—BaSO4,可知Na2SO3为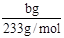 =
= 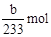 ,所以Na2SO3的质量分为数为
,所以Na2SO3的质量分为数为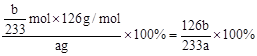 。
。
(3)保证实验的准确性就是不让SO2流失掉,所以硫酸应该在B中水面上方充满了黄绿色的气体的时候滴加。C中的NaOH是吸收尾气,防止污染大气。
(4)另外一种设计方案是将Na2SO3溶于水,然后向其中加入稀盐酸至不再产生气体为止,在加BaCl2溶液,然后将生成的沉淀过滤洗涤干燥称量其质量,求出Na2SO4的质量分数,继而求得Na2SO3的质量分数。所以使用试剂的顺序是①②④。2与Cl2的性质
点评:本题综合性强,主要考查学生分析实验设计实验的能力。
本题难度:一般