微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在一定温度下将1 mol CO和1 mol水蒸气放入一固定容积的密闭容器中,反应CO(g)+H2O(g)? ?CO2(g)+H2(g)达平衡后,得到0.6 mol CO2;再通入0.3 mol水蒸气,达到新平衡状态后,CO2的物质的量可能是( )
?CO2(g)+H2(g)达平衡后,得到0.6 mol CO2;再通入0.3 mol水蒸气,达到新平衡状态后,CO2的物质的量可能是( )
A.0.9 mol
B.0.8 mol
C.0.7 mol
D.0.6 mol
参考答案:C
本题解析:根据平衡时生成0.6molCO2可知,水蒸气的转化率是60%。再加入0.3mol水蒸气,则平衡向正反应方向进行,因此CO2的物质的量大于0.6mol,但水蒸气的转化率降低,所以平衡时生成的CO2最多是0.6×1.3mol=7.8mol,因此答案选C。
本题难度:一般
2、填空题 (8分)可逆反应 A(g) + 2B(g)  ?2C(g)? ΔH<0,在一定条件下达到平衡,若改变条件,将变化结果(“增大”、“减小”或“不变”)填入空格。
?2C(g)? ΔH<0,在一定条件下达到平衡,若改变条件,将变化结果(“增大”、“减小”或“不变”)填入空格。
(1) 升高温度,B的转化率?,v(正)?,v(逆)?。
(2) 保持温度和压强不变,加入惰性气体,则C的物质的量?,A的转化率?。
(3) 保持温度和体积不变,加入惰性气体,A的转化率?。
(4) 若温度和体积不变,反应从开始到平衡,容器内气体的密度?,压强?。
参考答案:(1)减小;增大;增大(2)减小;减小(3)不变(4)不变;减小
本题解析:(1)正反应是放热反应,所以升高温度,正逆反应速率都增大,但平衡向逆反应方向进行,B的转化率降低。
(2)保持温度和压强不变,加入惰性气体,则容器容积增大,所以平衡逆反应方向进行,C的物质的量和A的转化率都是减小的。
(3)保持温度和体积不变,加入惰性气体,物质的浓度不变,平衡不移动,A的转化率不变。
(4)密度是混合气的质量和容器容积的比值,在反应过程中质量和容积始终是不变的,所以容器内气体的密度不变,但压强是减小的。
本题难度:一般
3、选择题 把镁带投入盛有稀HCl的容器里,产生H2的速率与下列因素有关系的是
①盐酸的浓度;②温度;③镁带的表面积;④容器的密闭情况;⑤溶液的氯离子浓度
A.①②
B.③④
C.①②③④
D.①②③④⑤
参考答案:C
本题解析:反应的实质是Mg(s)+2H+==Mg2++H2↑;ΔH<0,反应速率除与氯离子浓度无关外,其他四个因素对反应速率都有影响。
本题难度:一般
4、填空题 尿素(H2NCONH2)是一种非常重要的高氮化肥,工业上合成尿素的反应如下:2NH3(l)+CO2(g)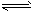 H2O(l)
H2O(l)
+H2NCONH2(l) △H=-103. 7kJ/mol
试回答下列问题:
(1)下列措施中有利于提高尿素的产率的是_____。
A.采用高温 B.采用高压 C.寻找更高效的催化剂
(2)合成尿素的反应在进行时分为如下两步:
第一步:2NH3(l)+CO2(g)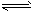 H2NCOONH4(氨基甲酸铵)(l) △H1
H2NCOONH4(氨基甲酸铵)(l) △H1
第二步:H2NCOONH4(l)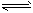 H2O(l)+H2NCONH2(l) △H2
H2O(l)+H2NCONH2(l) △H2
某实验小组模拟工业上合成尿素的条件,在一体积为0.5 L的密闭容器中投入4 mol氨和1mol二氧化碳,实验测得反应中各组分随时间的变化如甲图所示:
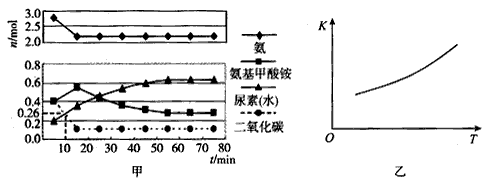
①已知总反应的快慢由慢的一步决定,则合成尿素总反应的快慢由第___ 步反应决定,总反应进行到
____min时到达平衡。
②反应进行到10 min时测得CO2的物质的量如甲图所示,则用CO2表示的第一步反应的速率v(CO2)=
________。
③第二步反应的平衡常数K随温度的变化如乙图所示,则△H2____0 (填“>”“<”或“=”)。
参考答案:(1)B
(2)①二;55;②0.148 mol/(L·min);③>
本题解析:
本题难度:一般
5、计算题 在一定温度下将100mLN2,H2混合气充入密闭恒压容器内,发生反应达到平衡时维持温度不变,测得混合气的密度是反应前密度的1.25倍,平均分子量为15.5。求平衡时N2的转化率;N2,H2两种气体开始时各为多少毫升?
参考答案:平衡时N2的转化率25%;N2,H2两种气体开始的体积分别为40mL和60mL。
本题解析:∵同T同P下有(ρ1/ρ2)=(m1/m2)

∴有(1/1.25)=(m1/15.5)?解得m1=12.4
(V1/V2)=(n1/n2)
即:?VN2∶VH2=10.4∶15.6
∴?VN2=10.4/(10.4+15.6)×100mL=40mL
?VH2=100mL-40mL=60mL
设N2转化的体积为x,则有:
? N2? + ?3H2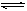 2NH3
2NH3
起始体积 40 60 0
转化体积 x 3x 2x
平衡体积 40-x 60-3x 2x
?V总=40-x+60-3x+2x=100-2x
∴有:
15.5=((40-x)×28+(60-3x)×2+2x×17)/(100-2x)
解得?x=10mL
∴N2的转化率为:
N2%=(10/40)×100%=25%
本题难度:简单