微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (3分)试用化合价升降法配平下列化学方程式。
?
?H2SO4+?H2S ——?SO2?+?S +?H2O
参考答案:1、1、1、1、2
本题解析:硫酸中S的化合价是+6价,H2S中S的个÷化合价是-2价,所以硫酸是氧化剂,硫化氢是还原剂。因为同一种元素之间发生氧化还原反应,生成物的化合价只能处于中间,而不能发生交叉,所以SO2是还原产物,单质S是氧化产物,即1mol硫酸得到2mol电子,1mol硫化氢失去2mol电子,所以方程式为H2SO4+H2S=SO2+S+2H2O。
本题难度:一般
2、选择题 已知2Fe2+ +Br2=2Fe3++2Br-,向10mL0.1mol·L-1的FeBr2溶液中通入0.001mol Cl2,反应后的溶液中,除含有Cl-外还一定(?)
A.含Fe2+,不含Fe3+
B.含Fe3+,不含Br-
C.含Fe3+,含Br-
D.含Fe2+,含Fe3+
参考答案:C
本题解析:由于亚铁离子的还原性强于溴离子的,所以首先被氧化的是亚铁离子,然后是溴离子。0.001mol氯气得到0.002mol电子,所以根据电子的得失守恒可知,还剩余0.001mol溴离子,剩余答案选C。
本题难度:一般
3、填空题 (1)配平氧化还原反应方程式:
___C2O42-+___MnO4-+___H+=___CO2+___Mn2++___H2O
(2)称取6.0g含H2C2O4·2H2O、KHC2O4和K2SO4的试样,加水溶解,配成250mL溶液。量取两份此溶液各25mL,分别置于两个锥形瓶中。
①第一份溶液中加入酚酞试液,滴加0.25mol/LNaOH溶液至20mL时,溶液由无色变为浅红色。该溶液被中和的H+的物质的量为_________mol。
②第二份溶液中滴加0.10mol/L的酸性高锰酸钾溶液至16mL时反应完全,此时溶液颜色由____________变为____________。该溶液中还原剂的物质的量为_________mol。
③原试样中H2C2O4·2H2O的质量分数为____________。
参考答案:(1)5 2 16 10 2 8
(2)①0.005;②无色;紫红色;0.004;③21%
本题解析:
本题难度:一般
4、填空题 氮气及含氮的化合物在国民经济中占有重要地位。合成氨工业中,合成塔中每产生2 mol NH3,放出92.4 kJ热量。
(1)若起始时向容器内放入2 mol N2和6 mol H2,达平衡后放出的热量为Q,则Q_____184.8kJ(填“>”、“<”或“=”) 。 一定条件下,在密闭恒容的容器中,能表示反应达到化学平衡状态的是____________。
a.3v逆(N2)=v正(H2) b.2v正(H2)= v正(NH3)
c.混合气体密度保持不变 d.c(N2):c(H2):c(NH3)=1:3:2
工业生产尿素的原理是以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为2NH3 (g)+ CO2 (g)  CO(NH2)2 (l) + H2O (l)。
CO(NH2)2 (l) + H2O (l)。
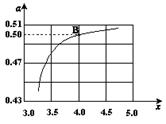
(2)在一定温度和压强下,若原料气中的NH3和CO2的物质的量之比(氨碳比)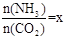 ,右图是氨碳比(x)与CO2平衡转化率(α)的关系。α随着x增大而增大的原因是___________。
,右图是氨碳比(x)与CO2平衡转化率(α)的关系。α随着x增大而增大的原因是___________。
(3)图中的B点处,NH3的平衡转化率为_______。
已知:3Cl2+2NH3→N2+6HCl
参考答案:
本题解析:
本题难度:困难
5、填空题 (4分)(1)配平下列化学反应方程式
Cu2S +? HNO3——? Cu(NO3)2 +? H2SO4 +? NO +? H2O
(2)标出电子转移的方向和数目。
(3)在标准状况下生成2.24LNO时,转移电子物质的量为?。
参考答案:(1)3;22;6;3;10;8 (2分)(2)略(1分)?(3)3mol(1分)
本题解析:略
本题难度:简单