微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 焰色反应可用来检验
A.所有元素的存在
B.所有金属单质的存在
C.某些金属单质或金属离子的存在
D.所有非金属元素的存在
参考答案:C
本题解析:试题分析:焰色反应只能用来检验某些金属元素的存在,不能检验所有元素或所有金属或非金属元素,A、B、D错误,C正确。
考点:考查焰色反应的检验对象
点评:紧扣焰色反应的定义即可。属于简单题。
本题难度:困难
2、填空题 几种短周期元素的原子半径及其某些化合价见下表:
元素代号
| A
| B
| D
| E
| G
| H
| I
| J
|
常见化合价
| -1
| -2
| +4、-4
| +6、+4、-2
| +5、-3
| +3
| +2
| +1
|
原子半径/pm
| 64
| 66
| 77
| 104
| 110
| 143
| 160
| 186
|
分析上表中有关数据,并结合已学过的知识,回答以下问题,涉及上述元素的答案,请用元素符号表示。
(1)E元素在周期表中位于?周期,?族。
(2) A、H、J对应离子的半径由大到小的顺序是(填离子符号)_________________。
(3)A与J所形成的化合物的晶体类型是?。
(4)DB2的结构式??。
(5)过量的D的最高价氧化物与一定量的J的最高价氧化物对应水化物X的溶液发
生反应的离子方程式:?。
参考答案:
(1)第三周期,ⅥA;
(2)F- >Na+ >Al3+
(3)离子晶体;
(4)O="C=O?" ;
(5)CO2 + OH- =H CO3-
本题解析:
本题考查物质结构与元素周期表。从数据分析,B和E位于ⅥA族,且B是氧元素,E是硫元素,D位于ⅣA族,为碳元素,A位于ⅦA族,半径小于B,为氟元素,G在ⅤA族,半径大于E,为磷元素,H位于ⅢA族,半径大于H,为铝元素,同理可知,I是镁元素,J是钠元素。(3)A与J所形成的化合物为NaF,是离子晶体;(4)DB2是CO2;(5)D的最高价氧化物是CO2,X是NaOH,方程式为:CO2 + OH-=HCO3-。
本题难度:一般
3、填空题 (6分)周期表中,前20号元素内X、Y元素的离子符号是xm+、yn-,他们的核外电子排布相同,据此可推得:元素X和 Y所属周期的周期数之差为_________,元素X和Y的核电荷数之差为(用含m、n的代数式表示)________________,Xm+、yn-的离子半径由大到小的顺序是________________。
参考答案:1,? m+n?,Yn-、Xm+(用>表示也可给分)
本题解析:xm+、yn-的核外电子排布相同,所以二者的周期数相差1;其中X的质子数比Y多m=n个。由于质子数越多,相应离子的半径越小,所以Xm+、yn-的离子半径由大到小的顺序Yn-、Xm+。
本题难度:一般
4、填空题 现有8种元素的性质、数据如下表所列,它们属于第二或第三周期。
| ①
| ②
| ③
| ④
| ⑤
| ⑥
| ⑦
|
原子半径(10-10m)
| 0.74
| 1.60
| 1.52
| 1.10
| 0.99
| 1.86
| 0.75
|
最高或最低化合价
| ?
| +2
| +1
| +5
| +7
| +1
| +5
|
-2
| ?
| ?
| -3
| -1
| ?
| -3
|
回答下列问题:
(1)③的元素符号是?,①在元素周期表中的位置是(周期、族)?。
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是___?____;
名称是?;
(3)比较④和⑦的氢化物的稳定性?(用化学式回答)
(4)写出②最高价氧化物对应水化物跟⑤的氢化物水溶液反应的离子方程式?。
参考答案:(1)Li ;第二周期第ⅥA族 (2)HClO4、高氯酸
(3)NH3 > PH3(4)Mg(OH)2 + 2H+=Mg2+ + 2H2O
本题解析:从图表数据可知,+1价的③、⑥,一定是碱金属Li和Na,而原子半径⑥>③,故③应为第IA族第二周期的Li,⑥为三周期的Na元素;④和⑦最高正价均为+5,负价一致,故为第VA族元素,因原子半径④>⑦,故④为第三周期第VA族的P元素,⑦为N元素;从化合价可推出⑤属于卤素,由于短周期F元素无正价,故⑤为氯元素,位于第VIIA族第三周期;①的最低负价为-价,无正价,则①应为第二周期的O元素,②最高正价+2价,无负价,只能是ⅡA族元素,且原子半径②<⑥,为第三周期的Mg元素。
(1)③的元素符号是Li;①在元素周期表中的位置是第二周期第ⅥA族。
(2)非金属性越强,最高价氧化物的水化物的酸性越强。则在最高价氧化物的水化物中,酸性最强的化合物的分子式是HClO4,名称是高氯酸。
(3)非金属性越强,氢化物的稳定性越强,所以④和⑦的氢化物的稳定性是NH3>PH3。
(4)②最高价氧化物对应水化物是氢氧化镁,⑤的氢化物水溶液是盐酸,二者反应的离子方程式是Mg(OH)2 + 2H+=Mg2+ + 2H2O。
点评:该题是中等难度的试题,也是高考中的常见考点和题型。本题从化合价和原子半径的角度来判断元素的种类,要求学生在学习中要注意把握相关周期律的递变规律,根据元素所在周期表中的位置,元素对应原子、单质以及化合物的结构和性质,结合元素周期律的递变规律解答该题。
本题难度:一般
5、选择题 如图为元素周期表中短周期的一部分,四种元素均为非稀有气体元素。下列关于这四种元素及其化合物的说法中正确的是(? )
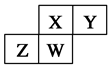
A.原子半径:W>Z>Y>X
B.气态氢化物的稳定性:Z>W>X>Y
C.W的最高正化合价与负化合价的绝对值可能相等
D.Z的最高价氧化物的水化物可能为强碱
参考答案:C
本题解析:A、Z、W同周期,所以原子半径Z>W,错误;B、Y的非金属性最强,所以气态氢化物最稳定,错误;C、从图中判断W是第四到第六主族的短周期元素,若为第四主族,则最高正化合价与负化合价的绝对值相等,正确;D、Z若为金属只能是Al,最高价氧化物的水化物是两性氢氧化物,错误,答案选C。
本题难度:一般