微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 a、b、c、d是四种短周期元素,a、b、c同周期,c、d同主族。a的原子结构示意图为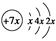 ,b与d形成的化合物的电子式为
,b与d形成的化合物的电子式为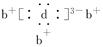 ,则下列叙述中正确的是
,则下列叙述中正确的是
( )。
A.原子序数:a>b>c
B.d单质最活泼
C.原子半径:a>c>d
D.最高价氧化物对应的水化物的酸性:d>a>c
参考答案:C
本题解析:根据核外电子排布规律知,x=2,a为Si,由b、d形成的化合物的电子式可知b为Na,d为N,c、d同主族,则c为P。原子序数:c>a>b,A错误;N2中含有N≡N键,性质很稳定,B错误;原子半径:a>c>d,C正确;最高价氧化物对应的水化物的酸性:d>c>a,D错误。
本题难度:一般
2、选择题 元素的原子结构决定其性质和在周期表中的位置,下列有关结构和性质的说法中,正确的是(?)
A.形成离子键的阴阳离子间只存在静电吸引力
B.元素周期表中,第三周期最右端的元素原子得电子能力最强
C.最易失去的电子能量最高
D.目前使用的元素周期表中最长的周期含有36种元素
参考答案:C
本题解析:离子键中的阴阳离子间既存在静电吸引力也存在排斥力,A项错误;元素周期表中,第三周期最右端的元素是零族元素,其原子既不容易得电子也不容易失电子,B项错误;电子能量越高越不稳定,越容易失去,C项正确;目前使用的元素周期表中最长的周期含有32种元素,D项错误。
本题难度:一般
3、选择题 短周期元素Q、R、T、W在元素周期表中的位置如右图所示,其中T所处的周期序数与主族序数相等,下列推测正确的是?(?)
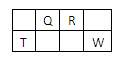
A.Q形成的化合物的种类最多
B.T位于元素周期表的第三周期第III族
C.Q和R的气态氢化物,前者比后者稳定
D.原子及简单离子半径均是T>W
参考答案:A
本题解析:很明显T为第三周期第IIIA族元素铝,则Q、R、W分别为碳、氮、硫元素
A:碳可形成化合物种类最多的有机物,正确
B:铝应属于第IIIA主族,不正确
C:氮的非金属性较强,其气态氢化物的稳定性就相对较强,错误
D:原子半径,铝较大,但离子半径硫离子较大,不正确
答案为A
本题难度:一般
4、填空题 (16分)图是元素周期表的框架,依据元素周期表回答下列问题:
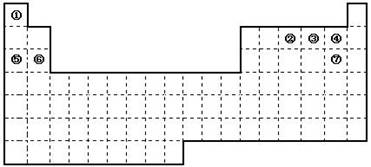
(1)周期表中的元素⑤和元素⑥的最高价氧化物的水化物碱性强弱顺序是?(用化学式表示),周期表中的元素④和元素⑦的氢化物的沸点高低顺序是?(用化学式表示)。
(2)①~⑦元素的单质,在常温下化学性质稳定,通常可用作保护气的是?(填写化学式)。
(3)①和②的单质在一定条件下转化为化合物A,请写出该反应的化学方程式?,及A的结构式?。
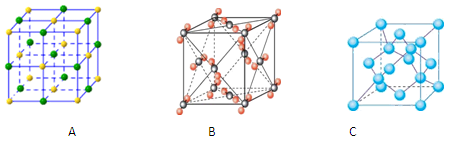
(4)②和硅形成的化合物是化工行业已合成的一种硬度很大、熔点很高的晶体,若已知在此化合物中各元素均处于其最高或最低价态,据此推断:该化合物的化学式可能是?,与该化合物晶体类型相同的是______(请用相应的编号填写)。
(5)请写出工业上用电解饱和食盐水制备⑦单质的化学方程式?。
参考答案:(1)NaOH>Mg(OH)2 ?HF>HCl
(2)N2
(3)N2+3H2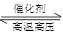 2NH3(有可逆号?条件不全也给分)氨的结构式略
2NH3(有可逆号?条件不全也给分)氨的结构式略
(4)Si3N4? C
(5)电解饱和食盐水方程式略
本题解析:由元素周期表可知①~⑦对应的元素分别为: ;
;
(1)周期表中的元素⑤和元素⑥的最高价氧化物的水化物碱性强弱顺序是NaOH>Mg(OH)2;周期表中的元素④和元素⑦的氢化物的沸点高低顺序是HF>HCl;
(2)①~⑦元素的单质,在常温下化学性质稳定,通常可用作保护气的是N2;
(3)①和②的单质在一定条件下转化为化合物A,其反应方程式为:N2+3H2 2NH3;氨的结构式为:
2NH3;氨的结构式为: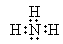 ;
;
(4)该化合物的化学式可能是Si3N4?;该化合物晶体类型相同的是C;
(5)工业上用电解饱和食盐水制备⑦单质的化学方程式为:
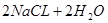 ======
======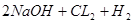 ;
;
本题难度:一般
5、选择题 随着科学 技术的不断进步,研究物质的手段和途径越来越多,N
技术的不断进步,研究物质的手段和途径越来越多,N 、H3、O4、C60等已被发现。下列有关说法中,正确的是?(?)
、H3、O4、C60等已被发现。下列有关说法中,正确的是?(?)
A.N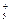 中含有36个电子
中含有36个电子
B.O2和O4属于同位素
C.C60晶体是原子晶体
D.H2和H3属于同素异形体
参考答案:D
本题解析:略
本题难度:简单