微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 如图所示装置中,甲、乙两个烧杯分别依次盛放200mL饱和食盐水、足量的AgNO3溶液,a、b、c、d四个电极均为石墨电极.接通电源,经过一段时间后,测得乙中d电极质量增加了2.16g.据此回答问题:
(1)电源的N端为______极;
(2)电极b上发生的电极反应为______;
(3)电极c上生成的气体在标准状态下的体积:______;
(4)甲溶液的pH为______(设溶液体积仍为200mL);
(5)欲在丙烧杯中实现铁的表面镀上一层锌,则电解质溶液为______,e电极的材料是:______,f电极的电极反应式为______.

参考答案:(1)测得乙中d电极质量增加了2.16g,则d电极发生Ag++e-=Ag,所以d电极为阴极,N为电源的负极,故答案为:负;
(2)电解食盐水,b为阴极,发生2H++2e?=H2↑,故答案为:2H++2e?=H2↑;
(3)d电极发生Ag++e-=Ag,c,发生4OH--4e-=2H2O+O2↑,由电子守恒可知4Ag~O2↑,则气体的体积为2.16g108g/mol×14×22.4L/mol=0.112L,故答案为:0.112L;
(4)由电子守恒可知2NaOH~2e-~2Ag,n(NaOH)=n(Ag)=0.02mol,则c(NaOH)=0.02mol0.2L=0.1mol/L,所以pH=13,故答案为:13;
(5)丙烧杯中实现铁的表面镀上一层锌,则电解质溶液为ZnCl2,e为Zn,f电极为阴极,其电极反应式为Zn2++2e-=Zn,故答案为:ZnCl2;Zn;Zn2++2e-=Zn.
本题解析:
本题难度:一般
2、填空题 下列装詈能否组成原电池?并判断其正负极。
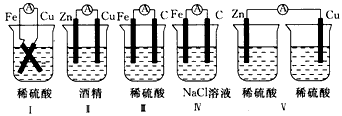
______________________________________
参考答案:I能,Fe为负极,Cu为正极
Ⅱ不能
Ⅲ能,Fe 为负极,C为正极
IV能,Fe为负极,C为正极
V不能
本题解析:
本题难度:一般
3、填空题 甲、乙两池电极材料如图所示,请按要求回答下列问题:
(1)若两池中均为Cu(NO3)2溶液,反应一段时间后:
①有红色物质析出的是甲池中的______棒(铁、碳);乙池中的______极(阴、阳).
②乙池中阳极上发生的电极反应方程式是______.
(2)若两池中均为饱和NaCl溶液:
①写出乙池中总反应的化学方程式______.
②甲池中碳极上电极反应方程式是______,乙池碳极上电极反应属于______(填氧化反应、还原反应).
参考答案:甲没有外接电源,所以是原电池,铁作负极,碳作正极;乙有外接电源,所以是电解池,根据电子的流向判断,铁作阴极,碳作阳极;
(1)①甲池中的?正极发生还原反应,有金属析出,所以是碳棒;
乙池中的阴极发生还原反应,有金属析出,所以是铁棒;
故答案为:碳;阴.
②乙池中阳极上发生氧化反应,氢氧根离子的放电能力大于硝酸根离子的放电能力,所以是氢氧根离子失电子生成氧气和水,故答案为:4OH--4e-═O2↑+2H2O
(2)①氯化钠溶液中存在的离子是:氯离子、氢氧根离子、钠离子、氢离子,氯离子的放电能力大于氢氧根离子,氢离子的放电能力大于钠离子,所以该反应的生成物是氯气、氢气、氢氧化钠.
故答案为:2H2O+2NaCl??电解?.?2NaOH+H2↑+Cl2↑
②在中性溶液中,溶有一定量的氧气,此时会发生吸氧腐蚀,负极上铁失电子,正极上氧气和水得电子生成氢氧根离子,乙池中碳棒作阳极,阳极上发生氧化反应,
故答案为:O2+4e-+2H2O═4OH-;氧化反应,
本题解析:
本题难度:一般
4、填空题 (10分)下图是一个化学过程的示意图。
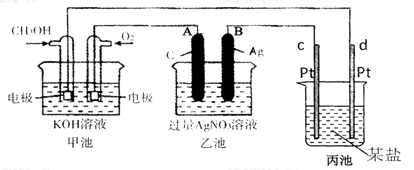
(1)图中乙池是 装置。
(2)c(Pt)电极的名称是 。
(3)写出通入CH3OH的电极的电极反应式是 。
(4)乙池中反应的离子方程式为 。
(5)当乙池中B(Ag)极的质量增加5.40g时,甲池中理论上消耗O2 mL(标准状况下);此时丙池某电极析出1.6g某金属,则丙中的某盐溶液可能是 (填序号)
A.MgSO4
B.CuSO4
C.NaCl
D.CuCl2