微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 [化学——选修化学与技术](15分)
工业上合成氨是在一定条件下进行如下反应:N2(g)+3H2(g) 2NH3(g),其
2NH3(g),其
部分工业流程如下:
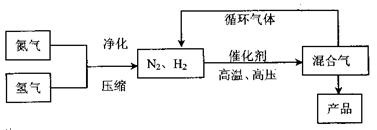
回答下列问题:
(1)已知:N2(g)+O2(g)=2NO(g)?△H=180.5kJ/mol
4NH3(g)+5O2(g)=4NO(g)+6H2O(g)?△H=-905kJ/mol
2H2(g)+O2(g)=2H2(g)?△H=-483.6kJ/mol
则N2(g)+2H2 2NH3(g)的△H=?;
2NH3(g)的△H=?;
(2)如果工业上,在一定温度下,将1.5molN2气体和6molH2气体通入到体积为1升的密闭容器中。当反应达到平衡时,容器内气体的压强为起始时的80%,则其平衡常数为?。改变下列条件,能使平衡向正反应方向进行且平衡常数不变的是?;
①增大压强?②增大反应物质的浓度
③使用催化剂?④降低温度
(3)合成氨反应的平衡常数很小,所以在工业采取气体循环的流程。即反应后通过降低混合气体的温度而使氢气分离出来。这种分离物质的方法其原理类似于下列哪种方
法??(填编号)
①过滤?②蒸馏?③渗析?④萃取
理由是?;
(4)可以用氯气来检验输送氨气的管道是否漏气,如果漏气则会有白烟(成份为氯化铵)生成。该反应的化学方程式为?;
(5)假如该厂生产氨水的物质的量浓度为20mol/L,实验室若需用80mL浓度为5mol/L的氨水时,需取20mol/L的氨水?mL(用100mL的容量瓶)。假如该氨水的pH=a,加入相同体积的盐酸时,溶液呈中性,则此盐酸的pH?14-a(填“大于”“小于”或“等于”)。
参考答案:
(1)-92.4kJ/mol
(2)0.057(mol·L-1)2,①②
(3)②;通过温度的改变而改变物质的状态,达到分离的目的。(如果没有谈到状态的改变,而只说温度不得分)。
(4)8NH3+3Cl2=N2+6NH4Cl
(5)25mL;小于
本题解析:略
本题难度:一般
2、实验题 【化学——化学与技术】
1942年我国化工专家侯德榜以NaCl、NH3、CO2等为原料先制得NaHCO3,进而生产出纯碱,“侯氏制碱法”为世界制碱工业做出了突出贡献。有关反应的化学方程式如下:
NH3+CO2+H2O=NH4HCO3,NH4HCO3+NaCl=NaHCO3↓+NH4Cl
2NaHCO3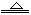 Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O
(1)“侯氏制碱法”把合成氨和纯碱两种产品联合生产,已知合成氨为放热反应,若从勒夏特列原理来分析,合成氨应选择的温度和压强是?(选填字母)。
a.高温? b.低温? c.常温? d.高压? e.低压? f.常压
(2)碳酸氢铵与饱和食盐水反应,能析出碳酸氢钠晶体的原因是?(选填字母)
a.碳酸氢钠难溶于水?
b.碳酸氢钠受热易分解?
c.碳酸氢钠的溶解度相对较小,所以在溶液中首先结晶析出
(3)某探究活动小组根据上述制碱原理,欲制备碳酸氢钠,同学们按各自设计的方案进行实验。
第一位同学:将二氧化碳气体通人含氨的饱和食盐水中制备碳酸氢钠,实验装置如下图所示(图中央持、固定用的仪器未画出)。
实验结束后,分离出NaHCO3晶体的操作是?(填分离操作的名称)。
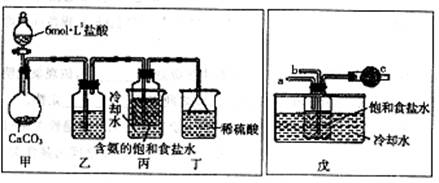
第二位同学:用图中戊装置进行实验(其它装置未画出)。
为提高二氧化碳在此反应溶液中被吸收的程度,实验时,须先从a管通入?气体,再从b管中通入?气体。
(4)请你再写出一种实验室制取少量碳酸氢钠的方法(用相关的化学反应方程式来描述):?。
参考答案:
(1)bd(2)c(3)过滤,氨气,CO2

本题解析:
(1)合成氨为气体物质的量减少的放热反应,高压、低温有利于提高氨的平衡浓度,从勒沙特列原理可以选择bd。
(2)根据复分解反应完成的条件可知,NaHCO3的溶解度较小,是析出碳酸氢钠晶体的主要原因,选c。
(3)固液分离操作用过滤操作。由于CO2的溶解度较小,因此通入CO2前,应先从a管通入氨气(防止NH3倒吸),因为氨气、H2O、CO2反应生成NH4HCO3,可以大大提高CO2的吸收,b管通入CO2有利于CO2的充分吸收。
(4)可以将过量的CO2通入NaOH溶液或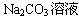 中。
中。
本题难度:简单
3、填空题 (10分)工业上冶炼钛主要以钛铁矿、金红石(含TiO2大于96%)等为原料生产。
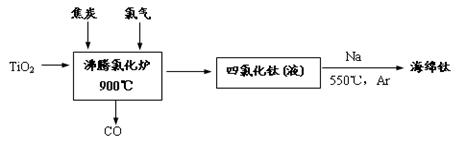
(1)由金红石为原料采用亨特(Hunter)法生产钛的流程如下:
①沸腾氯化炉中反应的化学方程式为:?
②已知:Ti(s) +2Cl2(g) = TiCl4(l)?△H = -804.2kJ/mol;
2Na(s) +Cl2(g) =" 2NaCl(s)?" △H = -882.0kJ/mol
Na(s) =" Na(l)?" △H ="2.6" kJ/mol
请写出用液态钠与四氯化钛置换出钛的热化学方程式?
③海绵钛破碎后用0.5%~1.5%的盐酸洗涤,再用蒸馏水洗涤至中性,用盐酸洗涤的目的是?。
(2)科学家从电解冶炼铝的工艺得到启发,找出了冶炼钛的新工艺。试回答下列有关问题。
①TiO2直接电解法(剑桥法)生产钛是一种较先进的方法,电解质为熔融的氯化钙,原理如图所示,在阴极,被还原的Ca进一步还原TiO2获得钛,则在阴极所发生的反应为:?。
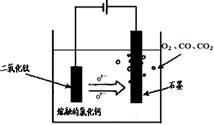
②SOM技术是一种绿色环保先进技术,阳极用金属陶瓷,并用固体氧离子隔膜将两极产物隔开,只允许氧离子通过,在电解过程中阳极通入某种还原性气体,可防止CO、CO2污染物产生,通入的气体若是H2,则阳极电解反应式为?。
参考答案:(共10分)
(1)①TiO2+2Cl2+2C=TiCl4 +2CO
②TiCl4(l) +4Na(l) =" Ti(s)" +4NaCl(s)?△H = -970.2kJ/mol?
③除去其中的过量的钠并溶解氯化钠及钛的氯化物
(2)①2Ca2++4e +TiO2 =" 2CaO" +Ti?②H2+O2--2e-=H2O
本题解析:略
本题难度:一般
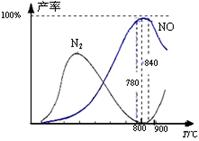
4、选择题 氨催化氧化是硝酸工业的基础,在某催化剂作用下只发生主反应①和副反应②,有关物质产率与温度的关系如右图。
4NH3(g)+5O2(g) 4NO(g)+6H2O(g)
4NO(g)+6H2O(g)
△H=-905 kJ·mol-1? ①
4NH3(g)+3O2(g) 2N2(g)+6H2O(g)
2N2(g)+6H2O(g)
△H=-1268 kJ·mol-1 ②
下列说法中正确的是
A.工业上氨催化氧化生成 NO时,温度应控制在
780~840℃之间
B.工业上采用物料比n(O2)/n(NH?3)在1.7~2.0,主要是为了提高反应速率
C.加压可提高NH3生成NO的转化率
D.N2氧化为NO的热化学方程式为:N2(g)+O2(g) 2NO(g) △H=-181.5 kJ·mol-1
2NO(g) △H=-181.5 kJ·mol-1
参考答案:A
本题解析:由图示可知在780~840℃之间NO的产率最高,故A项叙述正确;工业上采用物料比n(O2)/n(NH?3)在1.7~2.0,主要是为了提高NH3的利用率;NH3转化率NO的反应体积增大的反应,加压平衡左移,不利于提高NH3的转化率;利用“盖斯定律”知N2(g)+O2(g) 2NO(g) △H=+181.5 kJ·mol-1。
2NO(g) △H=+181.5 kJ·mol-1。
本题难度:一般
5、填空题

(1) 已知:450℃时NH3的浓度大于550℃时,则正反应是______? __热反应;
(2) 反应进程中:0~2s内N2的物质的量由2mol变为1mol,则υ(H2)=___________;
(3) 能说明该反应已经达到平衡状态的是_________?__;
A.c(N2)=c(H2)="c" (NH3)? B.容器内压强保持不变?
C.υ(N2)=3υ(H2)? D.容器内的密度保持不变
(4) 可使该反应的反应速率增大,且平衡向正反应方向移动的措施是__________。
A.及时分离出NH3气体? B.适当升高温度
C. 增大压强? D.选择高效的催化剂
参考答案:(1)放热(1分) (2)0.75mol/(L·s) (2分) (3)B (1分) (4)C(1分)
本题解析:本题考查化学反应速率及化学平衡有关知识,关键在于明确化学反应速率的影响因素及化学平衡的判断。(1)450℃时NH3的浓度大于550℃时,说明温度升高,平衡向逆反应方向移动,则正反应是放热反应;(2)υ(H2)=3υ(N2)=3(2-1)/(2×2)= 0.75mol/(L·s);(3) A中浓度相等,但不一定达到平衡,只有浓度不在改变时,表示达到了平衡,该反应是体积不相等的反应,体积固定,故压强不变,表示该反应已达平衡;C项中未指明是正反应速率还是逆反应速率,故不能表示该反应已达平衡;体积固定,质量不变,密度不变,故不能表示该反应已达平衡;故选B。
(4)及时分离出NH3气体,减少生成物,减小逆反应速率,A不合题意;适当升高温度,平衡向逆反应方向移动,B不合题意;增大压强,反应速率增大,平衡向正反应方向移动,C合题意,正确;催化剂只改变反应速率,不影响平衡移动,D不合题意,故选C。
本题难度:一般