微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 已知反应:2SO2(g)+ O2(g)  2SO3(g).某温度下,将2mol SO2和1mol O2置于10L密闭容器中,反应达平衡后,SO2的平衡转化率(α)与体系总压强(p)的关系如图甲所示。则下列说法正确的是
2SO3(g).某温度下,将2mol SO2和1mol O2置于10L密闭容器中,反应达平衡后,SO2的平衡转化率(α)与体系总压强(p)的关系如图甲所示。则下列说法正确的是
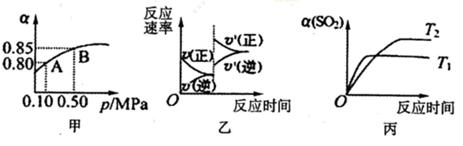
A.由图甲推断,B点SO2的平衡浓度为0.3mol·L-1
B.由图甲推断,A点对应温度下的平衡常数为80
C.达平衡后,缩小容器容积,则反应速率变化图像可以用图乙表示
D.压强为0.50 MPa时不同温度下SO2转化率与温度关系如丙图,则△H<0
参考答案:C
本题解析:A、B点SO2的平衡浓度为2×(1-0.85)÷10="0.03" mol·L-1,错误;
B、?2SO2(g)+ O2(g)  ?2SO3(g)
?2SO3(g)
始量? 2? 1
转化量? 1.6? 0.8? 1.6
平衡量? 0.4? 0.2? 1.6
平衡常数k=0.162/0.042×0.02=800,错误。
C、达平衡后,缩小容器容积,增大压强平衡正向移动,正反应速率大于逆反应速率且均比原来大,正确;D、Tl反应速率快,温度高,SO2转化率低平衡逆向移动,反应放热。
本题难度:一般
2、选择题 反应:A(g)+B(g) C(g),A的含量和温度的关系如图所示,下列结论正确的是:
C(g),A的含量和温度的关系如图所示,下列结论正确的是:
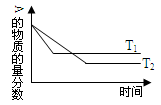
A.T1>T2, 正反应吸热
B.T1<T2, 正反应吸热
C.T1>T2, 正反应放热
D.T1<T2, 正反应放热
参考答案:C
本题解析:温度越高,反应速率越快,图像越陡;故T1>T2;温度升高,A的质量分数增大,故平衡逆向移动,逆向吸热,正反应放热。故C正确。
本题难度:简单
3、选择题 常温常压下,在带有相同质量活塞的容积相等的甲、乙两容器里,分别充有二氧化氮和空气,现分别进行下列两实验:(N2O4 2NO2 ΔH>0)
2NO2 ΔH>0)
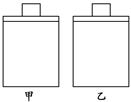
(a)将两容器置于沸水中加热(b)在活塞上都加2 kg的砝码
(b)在以上两情况下,甲和乙容器的体积大小的比较,正确的是(?)
A.(a)甲>乙,(b)甲>乙
B.(a)甲>乙,(b)甲=乙
C.(a)甲<乙,(b)甲>乙
D.(a)甲>乙,(b)甲<乙
参考答案:D
本题解析:(a)在沸水中,气体体积都受热膨胀,甲中存在平衡N2O4?2NO2△H>0,升高温度,平衡正向移动,使体积进一步增大,所以体积:甲>乙;(b)都加2kg的砝码,压强增大,气体都缩小,甲中存在平衡N2O4?2NO2 △H>0,增大压强,平衡逆向移动,体积减小得更多,所以体积:甲<乙;
本题难度:一般
4、填空题 (16分)某温度时,在2L容器中X、Y、Z三种气体物质的量随时间的变化关系曲线如图(2)所示。
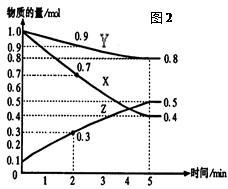
(1)由图中的数据分析,该反应的化学方程式为?。
(2)反应开始至5min,Z的平均反应速率为?;
(3)反应开始至5min ,正反应速率逐渐?;逆反应速率逐渐?, 5min后Z的物质的量不再改变,原因是下列的?;
A.正逆反应都停止了?
B.正反应速率为零
C.正逆反应速率相等,反应达到平衡状态
D.逆反应速率为零
(4)下列措施能使正反应速率增大的是?
A.升高温度? B.降低温度?
C.增大Y的浓度? D.减少Z的浓度
参考答案:(1)3X+Y 2Z?(3分)?(2)0.04 mol·(L·min)-1?(3分)
2Z?(3分)?(2)0.04 mol·(L·min)-1?(3分)
(3)减小,增大,C。(每空2分)?(4)AC(4分)
本题解析:(1)根据图像可知反应进行到5min时,各种物质的物质的量不在发生变化,说明反应达到平衡状态,此时XYZ的物质的量的变化量分别是(mol)1.0-0.4=0.6、1.0-0.8=0.2、0.5-0.1=0.4,由于变化量之比是相应的化学计量数之比,所以方程式为X+Y 2Z。
2Z。
(2)反应速率通常用单位时间内浓度额变化量来表示,所以Z的反应速率是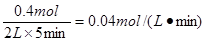 。
。
(3)由于随着反应的进行,反应物的浓度逐渐减小,生成物的浓度逐渐增大,所以正反应速率逐渐减小,逆反应速率逐渐增大。由于正逆反应速率相等(但不为0),所以反应达到平衡状态,即选项C是正确的,答案选C。
(4)考查外界条件对反应速率的影响,一般情况下,增大反应物的浓度、升高温度等可以使反应速率加快,所以答案选AC。
本题难度:简单
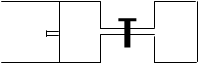
5、计算题 (6分)如图所示,向A中充入 1mol X和1mol Y,向B中充入 2mol X和2mol Y,
起始时VA=VB="aL" 。在相同温度和有催化剂存在的条件下,两容器各自发生下列反应:X + Y? ?2Z + W;正反应为放热反应,(四物质均为气体)。达到平衡时。VA="1.2a" L,试回答:? (A在的活塞可移动)?
?2Z + W;正反应为放热反应,(四物质均为气体)。达到平衡时。VA="1.2a" L,试回答:? (A在的活塞可移动)?
 ?
?
_? A? B
(1)A中的X的转化率 αA=__________;
(2)A、B中X的转化率αA?______αB? (填“>、=、<”)
(3)打开K,一段时间后又达到平衡时,A 的体积为_______ L(连通管中的气体体积不计)
参考答案:(1)40%(2分)(2)>(2分)(3)2.6aL(2分)
本题解析:(1)根据上图装置知A容器保持温度和压强一定,所以A容器的容积与A容器内气体的物质的量成正比,设A容器中消耗的X的物质的量为m,则有n(始):n(平)=V(始):V(平),即2:(2+m)=a:1.2a,所以m=0.4mol,故A容器中X的转化率为40%.
(2)对B容器来讲,开始时保持温度和体积一定,起始时B容器中各组分的浓度大于A容器中对应组分的浓度,根据浓度对化学反应速率的影响知开始时B容器中的化学反应速率大;欲比较A、B两容器中X的转化率的大小,可做如下假设:
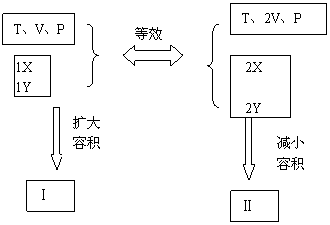 ?
?
_?A? B
假设过程中A与B为等效平衡,所以X的转化率相等,A扩大容积后,根据上述反应知A中X的转化率增大至40%,B中X的转化率减小,所以题设条件下B中X的转化率小于A中X的转化率。
(3)当活塞K打开后,A、B所组成的容器和原A容器均保持温度和压强一定,且反应物的物质的量之比相等,所以两者为等效平衡,反应达平衡时X的转化率为40%,所以此条件下反应达平衡时,A、B容器的总体积为3.6aL,故A容器的容积为2.6aL。
本题难度:一般