?
参考答案:(6分)
(1)B.D(1分)?(2)变大(1分)
(3)①:2< <28(2分)?②:若 <28(2分)?②:若 1<12,则 1<12,则 变小;; 变小;; 1>12则 1>12则 变大。(1分每空) 变大。(1分每空)
本题解析:略
本题难度:一般
2、选择题 在某一化学反应,0.5L的密闭容器中,反应物B的物质的量在5s内从2.0mol变成0.5mol,在这5s内B的化学反应速率为
[? ]
A.3mol/L
B.0.3mol/L·s
C.0.6mol/L·s
D.0.1mol/L·s
参考答案:C
本题解析:
本题难度:简单
3、选择题 在相同温度下,将H2和N2两种气体按不同比例通入相同的恒容密闭容器中,发生反应:3H2+N2 2NH3。 2NH3。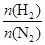 表示起始时H2和N2的物质的量之比,且起始时H2和N2的物质的量之和相等。下列图像正确的是( ) 表示起始时H2和N2的物质的量之比,且起始时H2和N2的物质的量之和相等。下列图像正确的是( )
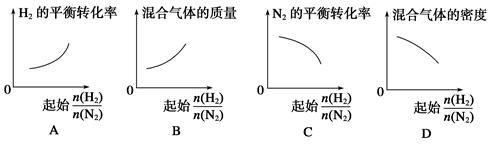
参考答案:D
本题解析:A、起始时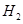 的物质的量越多, 的物质的量越多,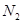 的平衡转化率越高,错误;B、起始时 的平衡转化率越高,错误;B、起始时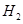 的物质的量越多,混合气体的质量越低,错误;C、错误;D、起始时 的物质的量越多,混合气体的质量越低,错误;C、错误;D、起始时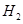 的物质的量越多,混合气体的密度越小,正确。 的物质的量越多,混合气体的密度越小,正确。
本题难度:一般
4、选择题 下列事实不能用勒夏特列原理解释的是(?)
A.配制FeSO4溶液时在溶液中加入稀硫酸
B.温度控制在450℃有利于二氧化硫的催化氧化
C.增大压强有利于合成氨反应
D.工业制取金属钾Na(l)+ KCl(l)  NaCl(l)+K(g)选取适宜的温度,使K成蒸气从反应混合物中分离出来 NaCl(l)+K(g)选取适宜的温度,使K成蒸气从反应混合物中分离出来
参考答案:B
本题解析:配制FeSO4溶液时在溶液中加入稀硫酸抑制亚铁离子水解,温度控制在450℃有利于二氧化硫的催化氧化,升温向逆向进行。增大压强向体积缩小的方向进行,有利于合成氨反应。
本题难度:简单
5、填空题 (16分)金属钨用途广泛,主要用于制造硬质或耐高温的合金,以及灯泡的灯丝。高温下,在密闭容器中用H2还原WO3可得到金属钨,其总反应为:
WO3(s)+3 H2(g)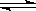 W(s)+3 H2O(g) W(s)+3 H2O(g)
请回答下列问题:
(1)上述反应的化学平衡常数表达式为?
(2)某温度下反应达平衡时,随温度的升高, H2与水蒸气的体积比减小,则该反应为_____________反应(填 吸热或放热)
(3)上述总反应过程大致分为三个阶段,各阶段主要成分与温度的关系如下表所示:
温度
| ?25 ℃? ~? 550 ℃? ~? 600℃? ~? 700℃
| 主要成分
| ?WO3?W2O5?WO2?W
|
第一阶段反应的化学方程式为___________________________________________ ;580℃时,固体物质的主要成分为______? _________;,
(4)已知:温度过高时,WO2(s)转变为WO2(g);
WO2(s)+2 H2(g)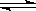 W(s)+2H2O(g)?ΔH=+66 kJ·mol-1 W(s)+2H2O(g)?ΔH=+66 kJ·mol-1
WO2(g)+2 H2(g)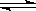 W(s)+2H2O(g)?ΔH= —137.9 kJ·mol-1 W(s)+2H2O(g)?ΔH= —137.9 kJ·mol-1
则WO2(s)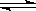 WO2(g)的ΔH=_____? _______. WO2(g)的ΔH=_____? _______.
(5)钨丝灯管中的W在使用过程中缓慢挥发,使灯丝变细,加入I2可延长灯管的使用寿命,其工作原理为:

下列说法正确的有____________.
A.灯管内的I2可循环使用
B.WI4在灯丝上分解,产生的W又沉积在灯丝上
C.WI4在灯管壁上分解,使灯管的寿命延长
D.温度升高时, WI4的分解速率加快,W和I2的化合速率减慢
参考答案:⑴K=c3(H2O)/c3(H2)?⑵吸热?⑶2WO3+H2 W2O5+H2O; W2O5 , WO2 W2O5+H2O; W2O5 , WO2
⑷ +203.9KJ/mol?⑸AB
本题解析:(1)化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,所以根据反应的化学方程式可知,该反应的平衡常数表达式K=c3(H2O)/c3(H2)。
(2)反应达平衡时,随温度的升高, H2与水蒸气的体积比减小,这说明升高温度平衡正反应方向移动,所以正反应是吸热反应。
(3)根据表中数据可知,第一阶段的生成物是W2O5,所以反应的化学方程式是2WO3+H2 W2O5+H2O。同样根据表中的数据可知,580℃时,固体物质的主要成分为W2O5和 WO2。 W2O5+H2O。同样根据表中的数据可知,580℃时,固体物质的主要成分为W2O5和 WO2。
(4)根据盖斯定律可知,①-②即得到WO2(s)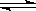 WO2(g),所以ΔH=+66kJ/mol+137.9kJ/mol=+203.9kJ/mol。 WO2(g),所以ΔH=+66kJ/mol+137.9kJ/mol=+203.9kJ/mol。
(5)该反应在不同温度下,反应进行的方向是不同的。高温下生成单质碘,而温度降低后,又消耗碘,所以灯管内的I2可循环使用,A正确;该方程式可知,WI4在灯丝上分解,产生的W是该题,会沉积在灯丝上,B正确,则C不正确;升高温度,反应速率都是增大,D不正确,答案选AB。
点评:该题是高考中的常见题型,属于中等难度的试题。试题基础性强,设计新颖。注重考查学生分析问题、解决问题的能力。该题在书写平衡常数的表达式时需要特别是注意物质的状态,不同有利于培养学生的灵活应变能力以及严谨的逻辑思维能力。
本题难度:困难
|