微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (8分)两个极易导热的材料做成的体积相等的容器A和B,A是密闭定容的,B带上下可移动的活塞(气体不渗漏).在等温下向A、B两容器中充入等物质的量的N2O4固体并使之迅速气化.

(1)在两容器内N2O4刚刚全部气化的时刻(温度相同),两容器中出现的现象是___________________________________________.
(2)反应进行的某时刻t1(s)时,两容器生成NO2的速率A B(大于、小于、等于),理由是 .
(3)当两容器内都达到平衡时,N2O4的转化率A B(大于、小于、等于),理由是 .
参考答案:(1)出现红棕色气体。( 2分)
(2)大于;N2O4 2NO2的反应是气体体积增大的反应,A容器定容,B容器定压,随着反应的进行PA>PB,所以vA>vB ( 3分)
2NO2的反应是气体体积增大的反应,A容器定容,B容器定压,随着反应的进行PA>PB,所以vA>vB ( 3分)
(3)小于;随着反应的进行,PA始终大于PB,压强大,平衡向逆方向移动,(或压强小,平衡向正方向移动)故转化率A<B。(3 分)
本题解析:(1)N2O4能转化为NO2,所以现象是出现红棕色气体。
(2)由于反应N2O4 2NO2是体积增大的,因此压强也是增大。而B是保持恒压的,所以B中压强小于A中压强,则B中反应速率小于A中反应速率。
2NO2是体积增大的,因此压强也是增大。而B是保持恒压的,所以B中压强小于A中压强,则B中反应速率小于A中反应速率。
(3)随着反应的进行,PA始终大于PB,压强大,有利于平衡向逆反应方向移动,(或压强小,平衡向正方向移动),所以转化率A<B。
本题难度:一般
2、填空题 (6分)某温度时,在一个2 L的密闭容器中,X、Y、Z三种气体物质的物质的量随时间的变化曲线如图所示。根据图中数据,试填写下列空白:
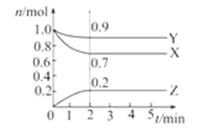
【小题1】该反应第 ______ 分钟到达平衡状态 。
【小题2】该反应的化学方程式为 。
【小题3】反应开始至2 min,气体X的平均反应速率为 。
参考答案:
【小题1】 2
【小题1】 3X + Y  2Z。
2Z。
【小题1】0.075 mol.L-1.min-1
本题解析:考查平衡状态的判断以及有关计算。根据图像可知X和Y的物质的量是减小的,Z的物质的量是增加的,所以X和Y是反应物,Z是生成物。反应进行到2min时各种物质的物质的量不再发生变化,所以反应达到平衡状态。此时X、Y、Z的物质的量的变化量分别为0.3mol、0.1mol、0.2mol,所以方程式为3X + Y  2Z。反应速率通常用单位时间内浓度的变化量来表示,所以X的平均反应速率为
2Z。反应速率通常用单位时间内浓度的变化量来表示,所以X的平均反应速率为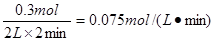 。
。
本题难度:一般
3、选择题 从下列叙述中,能肯定判断某化学平衡发生移动的是
[? ]
A.混合物中各组分的浓度改变
B.混合体系中气体密度发生变化
C.正、逆反应速率改变
D.反应物的转化率改变
参考答案:D
本题解析:
本题难度:一般
4、选择题 现向一密闭容器中充入1 mol N2和 3 mol H2,在一定条件下开始反应。下列有关说法中正确的是( )
A.达到化学平衡时,将生成2 mol NH3
B.达到化学平衡时,N2、H2和NH3的物质的量浓度一定相等
C.达到化学平衡时,N2、H2和NH3的物质的量浓度不再变化
D.达到化学平衡时,正反应和逆反应的速率都为零