微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 构造原理揭示的电子排布能级顺序,实质是各能级能量高低,若以E表示某能级的能量,下列能量大小顺序中正确的是
A.E(3s)>E(2s)>E(1s)
B.E(3s)>E(3p)>E(3d)
C.E(4f)>E(4s)>E(3d)
D.E(5s)>E(4s)>E(4f)
参考答案:A
本题解析:由能层和能级的能量大小比较规律可得,根据构造原理可知,A正确;
本题难度:一般
2、填空题 (8分)现有A、B、C三种元素,已知B原子序数大于A,A与B的质子数之和为27,质子数之差为5。0.9 g C单质与足量盐酸作用放出标准状况时1.12 L氢气,同时生成C的三氯化物。完成下列问题。
(1)A是_____________,B是_____________,C是_____________。
(2)排出三种元素最高价氧化物对应水化物酸、碱性强弱顺序__________________________。
参考答案:(1)Na、S、Al
(2)碱性:NaOH>Al(OH)3>H2SO4,酸性:NaOH<Al(OH)3<H2SO4或表示为:

NaOH? Al(OH)3? H2SO4[]碱性逐渐减弱,酸性逐渐增强。
本题解析:设A、B的质子数分别为a、b,则:a+b=27,b-a=5。解得:a=11,b=16,故A为Na元素,B为S元素。据题意:C应为三价金属元素,则有反应通式为:
2C+6H+====2C3++3H2↑
2M(C)? 3×22.4 L
0.9 g? 1.12 L
解得M(C)=27,故C为铝元素。找出元素性质的变化规律与核外电子排布或原子组成的内在联系,与元素周期律等内容紧密结合,并巧妙地揉入化学方程式计算,是此类练习的特点,必须做到基础知识熟悉,转化关系清楚,计算方法简单、明确,才能顺利作答。
本题难度:简单
3、选择题 下列比较不正确的是
A.最高价氧化物对应水化物的酸性:H3PO4>H2SO4>HNO3
B.与冷水的反应速率:K>Na>Mg
C.热稳定性:HF>HCl>H2S
D.离子半径:Cl->F->Na+
参考答案:A
本题解析:同周期最高价氧化物对应水化物的酸性从左向右逐渐增强,故H2SO4>H3PO4, A不正确;根据金属与水反应难易的递变规律即同周期从左向右越来越难,同主族从上到下,越来越易,可得B正确;同一周期,从左向右,气态氢化物的稳定性逐渐增强,同一主族,从上到下,逐渐减弱,故C正确;D中氯离子有三个电子层,半径最大,氟离子和钠离子具有相同的核外电子排布,核电荷数越大,离子半径越小,故D正确;故选A。
本题难度:一般
4、填空题 (12分)A、B、C、D、E、F、G均为短周期元素,原子序数依次递增。A元素原子核内无中子,B元素原子最外层电子数是次外层电子数的2倍,D是地壳中含量最多的元素,E是短周期中金属性最强的元素,F与G位置相邻,G是同周期元素中原子半径最小的元素。
请用化学用语回答:
(1)推断B元素在元素周期表中的位置?,写出C的单质的电子式?。
(2)A与D形成的18电子的化合物与FD2化合生成一种强酸,其化学方程式为?。
(3)E、F、G三种元素所形成的简单离子,其离子半径由大到小的顺序是?。(用离子符号表示)
(4)用电子式表示化合物E2F的形成过程?。
(5)下图为某新型发电装置示意图,其负极电极反应为?。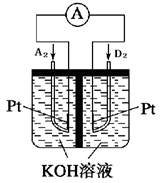
参考答案:(1)第二周期?ⅣA族(2分)? ?(2分)
?(2分)
(2) H2O2+SO2=H2SO4(2分)?(3) S2->Cl->Na+(2分)?
(4)略(2分)?
(5) H2-2e-+2OH-=2H2O(2分)
本题解析:“A元素原子核内无中子”,则A为11H;B元素的核外电子排布为2 4,则B为碳元素;“D是地壳中含量最多的元素”,则D为氧元素、C为氮元素;“E是短周期中金属性最强的元素”,则E为钠元素;“F与G位置相邻,G是同周期元素中原子半径最小的元素”,则G为氯元素、F为硫元素;
(1)电子层数=周期序数,最外层电子数=主族序数;
(2)H2O2(表现氧化性)与SO2(表现还原性)发生氧化还原反应;
(3)具有相同核外电子排布的离子,原子序数越大,离子半径越小,故S2->Cl-;
再S2-、Cl-核外有三层电子,Na+核外有两层电子,故S2->Cl->Na+;
(4)每个钠原子失去最外层的1个电子;硫原子得两个电子,使最外层达8电子稳定结构;
Na2S的电子式为:
(5)构成碱性条件下的氢氧原电池,故(-):H2-2e-+2OH-=2H2O;
本题难度:一般
5、填空题 A、B、C、D、E代表5种元素。请填空:
(1)A元素基态原子的最外层有3个未成对电子,次外层有2个电子,其元素符号为?;
(2)B元素的负一价离子和C元素的正一价离子的电子层结构都与氩相同,B的元素符号为?,C的元素符号为?;
(3)D元素的正三价离子的3d亚层为半充满,D的元素符号为?,其基态原子的电子排布式为?。
(4)E元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,E的元素符号为?,其E+ 的电子排布式为?。
参考答案:(1)N (2)C1 K? (3)Fe? ls22s22p63s23p63d64s2或[Ar]3d64s2
(4)Cu 1s22s22p63s23p63d10或[Ar]3d10
本题解析:(1)基态原子的最外层有3个未成对电子,次外层有2个电子的元素符号为N;(2)设元素B的核电荷数是a,C元素原子的核电荷数为b,因为阴离子B-与阳离子C+电子层结构都与氩相同相同,即核外电子数相同,所以a=18-1=17,b=18+1=19,则B的元素符号为Cl,C的元素符号为K;(3)D元素的正三价离子的3d亚层为半充满,即该正三价离子的所带的质子数为5+18+3=26,所以D的元素符号为Fe,其基态原子的电子排布式为:ls22s22p63s23p63d64s2或[Ar]3d64s2;(4)元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,则E为Cu,其E+ 的电子排布式为1s22s22p63s23p63d10或[Ar]3d10。
点评:本题考查了原子结构与元素的性质,核外电子排布,属于对基础知识的考查,该题有利于考查学生对基础知识的掌握情况,该题难度不大。
本题难度:一般